
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
【答案】B
【解析】
有机物A的分子式为C9H18O2,在酸性条件下A水解为B和C两种有机物,则有机物A为酯。B和C的相对分子质量相等,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,据此分析解答。
A.由以上分析可知C为C3H7COOH,E为C4H9COOH,二者互为同系物,故A正确;
B.C可能为CH3CH2CH2COOH,CH3CH(CH3)COOH,有2种,B能够氧化生成醛,说明B中含有-CH2OH结构,可能为CH3CH2CH2CH2CH2OH、CH3CH2CH(CH3)CH2OH、CH2(OH)CH2CH(CH3)CH3、CH3C(CH3)2CH2OH,有4种,共为2×4=8种,故B错误;
C.D为醛,可发生氧化反应生成酸,也可被还原是醇,故C正确;
D.由B的分析可知B可能为CH3CH2CH2CH2CH2OH、CH3CH2CH(CH3)CH2OH、CH2(OH)CH2CH(CH3)CH3、CH3C(CH3)2CH2OH,有4种,故D正确;
故选B。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
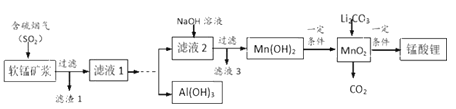
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1.01x105Pa时,将1L丙烷与若干升O2混合点燃充分燃烧后,恢复至原温度、压强,测得气体体积为aL,通过碱石灰后气体体积变为bL。
(1)若a-b=7, 则bL气体中一定含有____。
(2)若a-b=5,则混合前O2体积是______,点燃前混合气体的平均摩尔质量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.①、②、③的反应类型分别为卤代、水解、消去
C.A能使高锰酸钾酸性溶液褪色
D.A的结构简式是CH2=CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程_____________
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是_____________(写化学式)。
(3)配平下列反应方程式,并标出电子转移方向和数目___________。
Fe2++ O2 + H+== Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为___________L。
(4)通入二氧化碳的目的是_____________和______________。
(5)Cl2的作用是_____________________________。
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
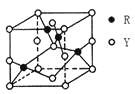
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOHB.NaClC.NaHCO3D.NH3![]() H2O
H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com