
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
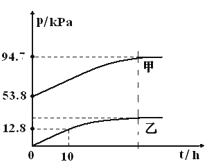
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
【答案】乙 28.2 3.38 0.05
【解析】
①根据最开始氧气的压强得出。
②根据氧气压强求算改变的压强,再根据起始压强求分解到10h时的压强,再根据速率公式计算。
③根据三段式计算,再求平衡时压强平衡常数。
①根据反应分析,随着反应的进行氧气的压强从0开始逐渐增大,所以乙为氧气的压强曲线,故答案为:乙。
②t=10h时,pO2=12.8 kPa ,2N2O5(g) = 4NO2(g)+O2(g)分析,反应的五氧化二氮的分压为25.6 kPa ,起始压强为53.8 kPa,所以10h时pN2O5=53.8kPa-25.6 kPa=28.2 kPa ,N2O5 分解的反应速率υ=0.12pN2O5(kPah-1)= 0.12×28.2= 3.38 kPah-1,故答案为:28.2;3.38。
③2N2O5(g) = 4NO2(g)+O2(g),
53.8kPa 0 0
53.8kPa 107.6kPa 26.9kPa
0 107.6kPa 26.9kPa
2NO2![]() N2O4
N2O4
起始分压107.6kPa 0
改变分压2x x
平衡分压107.6kPa-2x x
有107.6kPa-2x+x+26.9kPa=94.7 ,解x=39.8 kPa,平衡常数Kp=![]() =0.05kPa-1,故答案为:0.05。
=0.05kPa-1,故答案为:0.05。


科目:高中化学 来源: 题型:
【题目】25℃时,稀释HA、HB两种酸溶液,溶液pH的变化曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积。下列说法正确的是( )

A.曲线上a、b两点![]() 的值一定相等
的值一定相等
B.pH 相同时,c(HA)>c(HB)
C.当lg![]() =6时,HA溶液的pH=8
=6时,HA溶液的pH=8
D.已知,酸的酸性越强,其对应钠盐的碱性越弱,则25℃时,NaA溶液的pH 一定小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)![]()
![]() N2(g)+
N2(g)+![]() O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将_______(填变小、变大或不变);当外电路通过0.5 mol电子时,理论上负极板的质量增加__________g。
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:
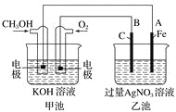
①甲池是________装置;通入CH3OH的电极名称是______,
②写出通入O2的电极的电极反应式是________________。
③A电极的电极反应式为_________________________。
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2_____mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是( )
A.CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B.Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl 制备TiO2·xH2O
TiO2·xH2O↓+4HCl 制备TiO2·xH2O
D.SnCl2+H2O![]() Sn(OH)Cl+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硅,二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性.
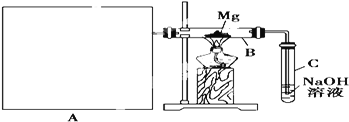
Ⅰ![]() 用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂_____________________________![]() 填序号
填序号![]() 。
。
①![]() 的硫酸溶液②
的硫酸溶液②![]() 硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
(2)写出装置B中发生置换反应的化学方程式:_____________________________装置C中氢氧化钠溶液的作用是_____________________________
(3)请在图中画出制备二氧化硫的发生装置,注明仪器名称,固定仪器省略不画。_______________
(4)你认为该装置的不足之处____________________________________________________![]() 任写2条
任写2条![]()
Ⅱ![]() 某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
他们在实验报告中记录着:“![]() 选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量
选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量![]() 在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的
在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的![]() 左右.”
左右.”
(5)该小组“实验室制硅”的化学方程式是_____________________________
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花:的原因是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如图所示的一系列星烷,如三星烷、四星烷、五星烷等。下列说法正确的是( )

A.它们之间互为同系物
B.六星烷的化学式为C18H24
C.四星烷与 互为同分异构体
互为同分异构体
D.它们的一氯代物均只有两种,而三星烷的二氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com