
【题目】25℃时,稀释HA、HB两种酸溶液,溶液pH的变化曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积。下列说法正确的是( )

A.曲线上a、b两点![]() 的值一定相等
的值一定相等
B.pH 相同时,c(HA)>c(HB)
C.当lg![]() =6时,HA溶液的pH=8
=6时,HA溶液的pH=8
D.已知,酸的酸性越强,其对应钠盐的碱性越弱,则25℃时,NaA溶液的pH 一定小于NaB溶液
【答案】AD
【解析】
在25℃下,稀释HA、HB两种酸溶液pH=2,加水稀释至![]() ,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
在25℃下,稀释HA、HB两种酸溶液pH=2,加水稀释至![]() ,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
,稀释100倍,HA溶液pH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸。
A.曲线上a、b两点,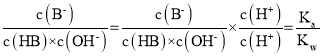 温度不变比值一定不变,所以比值一定相等,故A正确;
温度不变比值一定不变,所以比值一定相等,故A正确;
B.HA为强酸,HB为弱酸存在电离平衡,pH相同时,c(HA)<c(HB),故B错误;
C.HA为强酸,lg![]() =6时,稀释106倍,此时需要考虑水的电离,溶液pH接近7,不可能变化为碱,故C错误;
=6时,稀释106倍,此时需要考虑水的电离,溶液pH接近7,不可能变化为碱,故C错误;
D.HA为强酸,HB为弱酸,25℃时,NaA是强酸盐溶液的pH=7,NaB溶液中B离子水解溶液显碱性pH>7,NaA溶液的pH一定小于NaB溶液,故D正确;
故选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是

A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
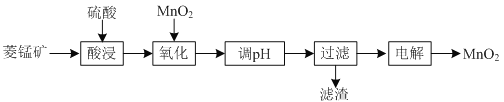
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物,其合成路线如下:

(1)G中的含氧官能团名称为羟基、____、____。
(2)A→B的反应类型为____。
(3)E的结构简式为____。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:____。
Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.能与FeCl3发生显色反应,核磁共振氢谱图中有4个峰。
(5)已知:![]() (R’表示烃基或氢原子)。请写出以
(R’表示烃基或氢原子)。请写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。_______
的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是

A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是__(填序号)
①配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质
(2)若25℃时,0.10mol/L的CH3COOH的电离度为1%,则该溶液的pH=___,由醋酸电离出的c(H+)约为水电离出的c(H+)的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水中c(H+)=2×10﹣7 molL﹣1,则此时温度____填(“高于”、“低于”或“等于”)25°C,此温度下水的离子积为____。若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 molL﹣1,则此时c(OH﹣)=____。由水电离产生的c(H+)为____
(2)25℃,有pH=12的氢氧化钠溶液100mL,要使它的pH降为11.应加蒸馏水的体积为_____mL;若加pH=10的氢氧化钠溶液,应加_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
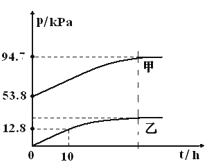
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPah-1),t=10h时,pN2O5=___kPa,υ=_________kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com