
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是

A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
【答案】D
【解析】
试题A、根据图像可知前5min内生成N2O4的浓度是0.9mol/L,则反应的平均速率v(N2O4)=0.9mol/L÷5min=0.18mol·L-1·min-1,A错误;B、T1℃时反应②平衡时N2O4的浓度是0.9mol/L,NO2的浓度是1.5mol/L,则反应②的化学平衡常数K=![]() ,B错误;C、10min后升高并维持容器的温度为T2℃,此时N2O4的浓度降低,NO2的浓度升高,这说明反应②是放热反应。N2O4浓度减少0.2mol/L,但NO2浓度只增加0.1mol/L,这说明反应①升高温度后平衡向逆反应方向进行,即正方应也是放热反应,C错误;D、若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,则根据方程式可知相当于起始时加入了7.6mol NO和3.8mol O2,,所以平衡是等效的,则T1℃达到平衡时,N2O4的物质的量是0.9mol/L×2=1.8mol,即消耗0.2molN2O4,所以N2O4的转化率为10%,D正确,答案选D。
,B错误;C、10min后升高并维持容器的温度为T2℃,此时N2O4的浓度降低,NO2的浓度升高,这说明反应②是放热反应。N2O4浓度减少0.2mol/L,但NO2浓度只增加0.1mol/L,这说明反应①升高温度后平衡向逆反应方向进行,即正方应也是放热反应,C错误;D、若起始时向该容器中充入3.6mol NO2和2. 0mol N2O4,则根据方程式可知相当于起始时加入了7.6mol NO和3.8mol O2,,所以平衡是等效的,则T1℃达到平衡时,N2O4的物质的量是0.9mol/L×2=1.8mol,即消耗0.2molN2O4,所以N2O4的转化率为10%,D正确,答案选D。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】向体积为V L的恒容容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下图所示。已知在反应过程中混合气体的总的物质的量没有变化。请回答:
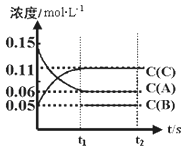
(1)V =_________。
(2)若t1=15s时,则0-t1阶段以C物质浓度变化表示的反应速率v(C)=__________。
(3)写出反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某试样焰色反应呈黄色,则试样中含有K+
B. 用广泛pH试纸测得NaClO溶液的pH值为12
C. 可用酒精代替CCl4萃取碘水中的碘单质
D. 金属镁失火不可用水来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】各式各样电池的迅速发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是()
A.手机上用的锂离子电池属于一次电池。B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池工作时氢气在负极上被还原D.太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是位于短周期的主族元素。已知:A、B、C、E在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小; A与B质子数之和是D质子数的3倍;C m- 、E (m-1)- 具有相同的电子层结构;热稳定性:H m D>H m C。依据上述信息用相应的化学用语回答下列问题:
(1)H m D m 的电子式为____________________
(2)C m- 、E (m-1)- 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)B单质与A的最高价氧化物对应水化物反应的化学方程式为:______________________。
(4)常温下,将CD m 通入H m C溶液中,有C析出,写出该过程的化学方程式__________________ 。
(5)在A、B、C、E单质中,符合下列转化关系的是___________(填元素符号)。![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
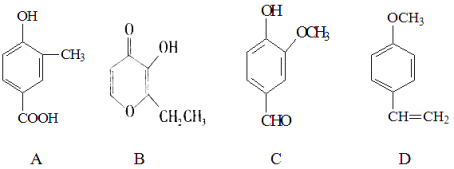
(1)化合物A的分子式是 ;A中含有的官能团的名称是 、
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号) ;
(3)化合物B的核磁共振氢谱中出现 组峰;
(4)1mol D最多能与 mol的氢气发生加成反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示:
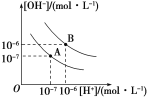
(1)若以A点表示25 ℃时水电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100 ℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[Am+]n·[Bn-]m,在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g·cm-3,其离子积为K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
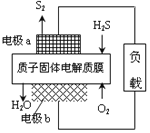
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com