
【题目】下列说法正确的是
A. 某试样焰色反应呈黄色,则试样中含有K+
B. 用广泛pH试纸测得NaClO溶液的pH值为12
C. 可用酒精代替CCl4萃取碘水中的碘单质
D. 金属镁失火不可用水来灭火
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g),反应过程如下图所示,下列说法正确的是
2NH3(g),反应过程如下图所示,下列说法正确的是
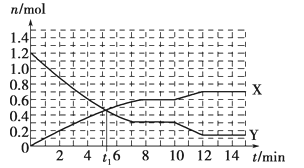
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=3/4 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和水的混合液;②45%的酒精溶液;③提取碘水中的碘单质。分离以上各种混合液的正确方法是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的说法中,不正确的是( )
A. 化学反应一定伴随能量变化
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 放热反应中反应物的总能量大于生成物的总能量
D. 需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(其中III、IV中均为浓硫酸):
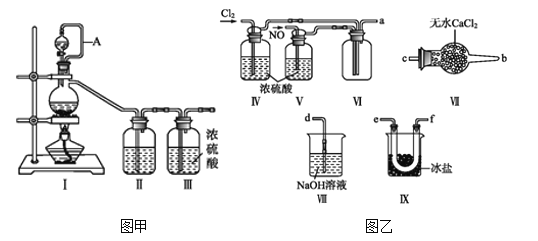
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | 浓盐酸 | ①___ |
制备纯净NO | Cu | 稀硝酸 | ②___ |
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你同意此观点吗?________(填同意或不同意),原因是________________________________。
④实验开始的时候,先通入氯气,再通入NO,原因为________________。
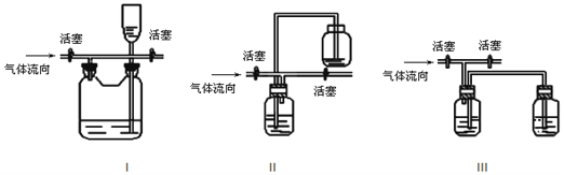
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6625 g样品溶于50.00 ml NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀,消耗AgNO3溶液50.00ml。
①样品的纯度为__________%(保留1位小数)
②已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12,若在滴定终点时测得溶液中Cr2O42-的浓度是5.0×10-3 mol/L,此时溶液中Cl-浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/ c(OH-) = 1×10-12的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe3+) =1 mol·L-1的溶液中: Na+、NH4+、AlO2-、SO42-
D. 能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室加热高锰酸钾制取氧气,用排水法收集满氧气后,下一步应采取的操作及原因是
A. 先熄灭酒精灯,以节约燃烧
B. 先把导管移出水面,再熄灭酒精灯以免水倒吸引起试管炸裂
C. 先撤酒精灯,再撤导气管,防止水倒吸
D. 检验收集的气体是否纯净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是

A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)(合金中金属化合价均为0)有储氢性能,下列说法正确的是( )
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 1molMg17Al12与盐酸完全反应放出H2为35mol
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)>V(合金)>V(Al)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com