
【题目】新型镁铝合金(Mg17Al12)(合金中金属化合价均为0)有储氢性能,下列说法正确的是( )
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 1molMg17Al12与盐酸完全反应放出H2为35mol
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)>V(合金)>V(Al)
【答案】B
【解析】
A.制备该合金如果在氮气保护下,Mg单质在一定温度下熔炼时,镁和氮气反应3Mg+N2![]() Mg3N2,A错误;
Mg3N2,A错误;
B.1molMg17Al12中含17molMg、12molAl,分别与HCl反应产生氢气的物质的量分别是17mol、12mol×![]() =18mol,因此在与盐酸反应时生成氢气的总物质的量分别为35mol,B正确;
=18mol,因此在与盐酸反应时生成氢气的总物质的量分别为35mol,B正确;
C.镁铝合金中的Mg、Al都是比较活泼的金属,可以与盐酸发生反应产生MgCl2、AlCl3,但Mg不能与NaOH溶液反应,因此不能完全溶解在NaOH溶液中,C错误;
D若金属质量为mg,若完全为Mg,放出氢气的物质的量为![]() mol,若完全是Al,反应放出氢气的物质的量为
mol,若完全是Al,反应放出氢气的物质的量为![]() =
=![]() mol,若为镁铝合金,放出氢气的物质的量介于二者之间,即
mol,若为镁铝合金,放出氢气的物质的量介于二者之间,即![]() mol <n(H2)<
mol <n(H2)<![]() mol,氢气的物质的量越大,在相同外界条件下其体积越大,所以等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)<V(合金)<V(Al),D错误;
mol,氢气的物质的量越大,在相同外界条件下其体积越大,所以等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)<V(合金)<V(Al),D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某试样焰色反应呈黄色,则试样中含有K+
B. 用广泛pH试纸测得NaClO溶液的pH值为12
C. 可用酒精代替CCl4萃取碘水中的碘单质
D. 金属镁失火不可用水来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
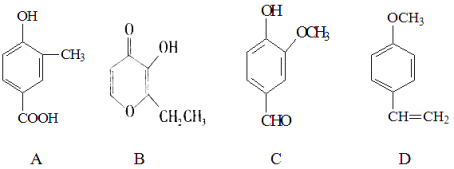
(1)化合物A的分子式是 ;A中含有的官能团的名称是 、
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号) ;
(3)化合物B的核磁共振氢谱中出现 组峰;
(4)1mol D最多能与 mol的氢气发生加成反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示:
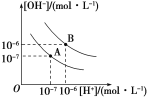
(1)若以A点表示25 ℃时水电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100 ℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[Am+]n·[Bn-]m,在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g·cm-3,其离子积为K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯、乙酸、乙醇说法正确的是
A. 都不易溶于水
B. 除乙酸外,其余都不能与金属钠反应
C. 苯能与溴水在铁作催化剂下发生取代反应
D. 乙醇与乙酸都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置制取少量溴苯,回答下列问题。

(1)三颈烧瓶中反应的化学方程式是:__________________________________;
(2)滴入苯和液溴,观察到三颈烧瓶中的现象_____________;
(3)反应过程中在锥形瓶导管出口附近可以观察到的现象是 ___________________,导管口不能插入锥形瓶中液面以下的原因是__________________________________;
(4)洗气瓶中盛放CCl4的作用是_____________,干燥管的作用是 ________________;
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向锥形瓶中加入_________,现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
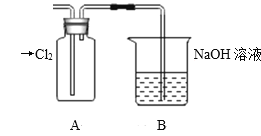
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法不正确的是( )
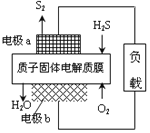
A. 电极a为电池的负极
B. 电极b上发生的电极反应为:O2+4H++4e-═2H2O
C. 电路中每流过2mol电子,在正极消耗22.4L H2S
D. 每34g H2S参与反应,有2mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物A中C、H、O三种元素的质量分数分别为37.5%、4.2%和58.3%。请填空:
(1)0.01 mol A在空气中充分燃烧需消耗氧气1.0 L(标准状况),则A的分子式是________。
(2)实验表明:A分子中不含醛基。1 mol A与足量的碳酸氢钠溶液反应可放出3 mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。A分子的核磁共振氢谱中有4个吸收峰,且峰面积之比为1∶2∶2∶3。则A的结构简式是____________________。
(3)在浓硫酸催化和适宜的反应条件下,1 mol A与 3 mol乙醇反应生成B,则B的化学式为________,官能团的名称为________,由A生成B的反应类型是____________,该反应的化学方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com