
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
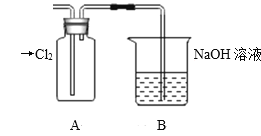
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
【答案】X>Z>Y A B Cl2+Na2S=2NaCl+S↓ B 变蓝 原子半径递增,得电子能力递减
【解析】
I.金属越活泼,与水或酸反应置换出氢气越容易;
根据同一周期的元素,原子序数越大,原子的最外层电子数越多,原子半径越小,元素的最高价氧化物对应的水化物的碱性越弱分析判断;
II. (1)要验证Cl的非金属性比S强,可通过单质之间的置换反应判断;
(2)根据判断元素非金属性强弱的方法进行判断;
(3)活动性强的可以将活动性弱的置换出来,结合碘单质遇淀粉溶液变为蓝色判断;同一主族元素从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱。
I.根据实验1可知X、Z与水混合,金属X与水反应比金属Z剧烈,说明金属活动性X>Z;根据实验2:等质量的金属Z和金属Y分别加入到5mL1.0mol/L盐酸中,金属Z与盐酸反应比金属Y剧烈,说明金属活动性Z>Y,故三种金属活动性X>Z>Y;
A.同一周期的元素,原子序数越大,原子半径越小,金属活动性越弱,所以原子序数:X<Z<Y;A正确;
B.同一周期的元素,原子最外层电子数越多,原子半径越小,元素的金属性越弱,所以三种元素的原子的最外层电子数X<Z<Y,B错误;
C.同一周期的元素,原子最外层电子数越多,原子半径越小,元素的金属性越弱,由元素的金属性X>Z>Y,可知原子半径:Y<Z<X,C错误;
D.Y的金属性最弱,所以Y的最高价氧化物对应水化物的碱性最弱,D错误;
故合理选项是A;
II. (1) A.Cl2可以与Na2SO3溶液反应产生HCl、Na2SO4,但不能判断Cl与S非金属性强弱,A错误;
B.Na2S溶液与Cl2发生反应:Cl2+Na2S=2NaCl+S↓,会看到溶液中产生淡黄色浑浊,因此可以证明元素的非金属性Cl>S,B正确;
C.Cl2与Na2SO4溶液不能反应,无明显现象,不能判断Cl与S非金属性强弱,C错误;
故合理选项是B;
(2)A.元素的非金属性越强,其相应的氢化物稳定性越强,根据HCl比H2S稳定可知元素的非金属性Cl>S,A不符合题意;
B.HClO氧化性比H2SO4强,与元素的非金属性强弱无关,B符合题意;
C.元素的非金属性越强,其最高价含氧酸的酸性越强,由于HClO4酸性比H2SO4强,可知元素的非金属性Cl>S,C不符合题意;
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS,说明Cl2的氧化性比S强,从而可证明元素的非金属性Cl>S,D不符合题意;
故合理选项是B;
(3)活动性强的可以将活动性弱的置换出来,将Cl2通入KI淀粉溶液中,发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色;Cl元素的非金属性比I强是由于同主族元素从上到下,原子半径递增,得电子能力递减,故单质的氧化性逐渐减弱,元素的非金属性逐渐减弱。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室加热高锰酸钾制取氧气,用排水法收集满氧气后,下一步应采取的操作及原因是
A. 先熄灭酒精灯,以节约燃烧
B. 先把导管移出水面,再熄灭酒精灯以免水倒吸引起试管炸裂
C. 先撤酒精灯,再撤导气管,防止水倒吸
D. 检验收集的气体是否纯净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为______________________________________。
(2)B为0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因___________________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)(合金中金属化合价均为0)有储氢性能,下列说法正确的是( )
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 1molMg17Al12与盐酸完全反应放出H2为35mol
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)>V(合金)>V(Al)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与生产、生活和科技密切相关。回答下列问题:
(1)下列物质中属于复合材料的是___________(填标号)。
A.钢化玻璃 B.玻璃钢 C.钢筋混凝土 D.水泥
(2)钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,请以氧化物组成的形式表示钾长石的化学式____________。
(3)新型无机非金属材料碳化硅陶瓷(SiC)是一种耐高温陶瓷,反应原理为SiO2+3C![]() SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________。
SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________。
(4)金属材料的应用更是广泛。①工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是________________。
②铝热反应可用于冶炼难熔的金属,请写出Al与Cr2O3反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C5H8O,其能发生银镜反应,也能与Br2发生加成反应,若将它与H2加成,所得产物不可能是下列有机物中的( )
①(CH3)3CCH2OH ②(CH3CH2)2CHOH ③CH3(CH2)3CH2OH ④(CH3)2CHCH2CH2OH ⑤CH3CH2CH(CH3)CH2OH
A.①②B.③④C.①②③④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
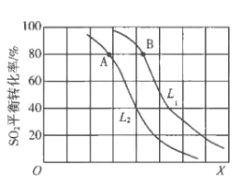
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中:
①NH4CNO与CO(NH2)2,②CuSO4·5H2O与CuSO4,③H2O与D2O,④H、D与T,⑤O2与O3,⑥CH3CH2CH3与CH3CH2CH2CH3,⑦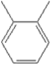 与
与![]() ,⑧CH3—CH2—CH=CH2与CH3—CH=CH—CH3,⑨
,⑧CH3—CH2—CH=CH2与CH3—CH=CH—CH3,⑨ ,⑩
,⑩![]() 与
与![]() ,
,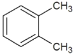 与
与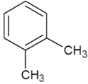 ,
,
互为同位素的是________,互为同素异形体的是________,互为同分异构体的是________,互为同系物的是________,是同一种物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二甲醚(CH3OCH3)和乙醇是同分异构体,下列鉴别方法中不可行的是( )
A.利用质谱法B.利用金属钠
C.利用红外光谱法D.利用核磁共振氢谱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com