
【题目】(1)某温度下,纯水中c(H+)=2×10﹣7 molL﹣1,则此时温度____填(“高于”、“低于”或“等于”)25°C,此温度下水的离子积为____。若温度不变,滴入稀盐酸使c(H+)=5×10﹣4 molL﹣1,则此时c(OH﹣)=____。由水电离产生的c(H+)为____
(2)25℃,有pH=12的氢氧化钠溶液100mL,要使它的pH降为11.应加蒸馏水的体积为_____mL;若加pH=10的氢氧化钠溶液,应加_____mL。
【答案】高于 4×10﹣14 8×10﹣11mol/L 8×10﹣11mol/L 900 1000
【解析】
(1) 纯水中c(H+)=c(OH-),Kw=c(H+)×c(OH-),水的离子积常数只与温度有关,与溶液的酸碱性无关,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,水的电离是吸热反应,升高温度能促进水电离,所以温度越高,水的离子积常数越大,据此分析解答;
(2) 先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积。
(1) 纯水中c(H+)=c(OH-)=2×10-7molL-1,Kw=c(H+)c(OH-)=2×10-7×2×10-7=4×10-14>1×10-14,水的电离是吸热反应,升高温度能促进水电离,温度越高,水的离子积常数越大,则该温度高于25°C;温度不变,水的离子积常数不变,滴入稀盐酸使c(H+)=5×10-4molL-1,此时c(OH-)=![]() =
=![]() mol/L=8×10-11mol/L,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以水电离出的H+浓度是8×10-11mol/L;
mol/L=8×10-11mol/L,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以水电离出的H+浓度是8×10-11mol/L;
(2) pH=12 的NaOH溶液中氢氧根离子浓度为0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,解得:V2=![]() =0.9L=900mL;
=0.9L=900mL;
pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L;设加入pH=10的NaOH溶液体积是V2,c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),解得:V2=1L=1000mL。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,稀释HA、HB两种酸溶液,溶液pH的变化曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积。下列说法正确的是( )

A.曲线上a、b两点![]() 的值一定相等
的值一定相等
B.pH 相同时,c(HA)>c(HB)
C.当lg![]() =6时,HA溶液的pH=8
=6时,HA溶液的pH=8
D.已知,酸的酸性越强,其对应钠盐的碱性越弱,则25℃时,NaA溶液的pH 一定小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)如图所示:1molCH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。
在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式___。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率和S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率和S2(g)的生成速率随温度变化的关系如图所示:

①A、B、C、D四点对应的状态中,达到平衡状态的有___(填字母)。
②该反应的ΔH___0(填“>”“<”或“=”)
③下列措施能够增大SO2平衡转化率的是___。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=___(α=![]() ×100%)。。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的![]() =___。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=___。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8。
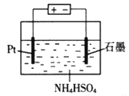
写出电解NH4HSO4溶液的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是
A.食醋呈酸性的原因是:CH3COOH+H2O=CH3COO-+H3O+
B.纯碱溶液呈碱性的原因是:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O![]() Fe(OH)2+H2↑
Fe(OH)2+H2↑
D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);![]() H=-571.6KJ·mol—1
H=-571.6KJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在科学家正在寻求将太阳能转化成化学能的方法,其中之一就是利用太阳能将![]() 分解成
分解成![]() ,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
,再将化学能转化为其他能源。下面是有关的能量循环示意图,下列有关说法正确的是
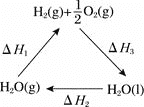
A.图中![]()
B.如果![]() 的键能为
的键能为![]() ,
,![]() 键能为
键能为![]() ,则断开
,则断开![]() 水蒸气中
水蒸气中![]() 键所需要的太阳能为
键所需要的太阳能为![]()
C.![]() 燃烧热为
燃烧热为![]()
D.水蒸气所具有的能量比液态水多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)![]()
![]() N2(g)+
N2(g)+![]() O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如图所示的一系列星烷,如三星烷、四星烷、五星烷等。下列说法正确的是( )

A.它们之间互为同系物
B.六星烷的化学式为C18H24
C.四星烷与 互为同分异构体
互为同分异构体
D.它们的一氯代物均只有两种,而三星烷的二氯代物有四种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com