
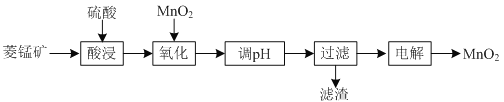
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
【答案】MnCO3+2H+=Mn2++CO2↑ +H2O 提高菱锰矿中锰元素的浸出率![]() 提高菱锰矿的转化率
提高菱锰矿的转化率![]() 抑制
抑制![]() 的水解 升高温度或将菱锰矿粉碎
的水解 升高温度或将菱锰矿粉碎 ![]() 5.0~7.8 1.0×10-32
5.0~7.8 1.0×10-32
【解析】
![]() ,
, ![]() 、
、![]() 溶于硫酸,溶液中阳离子主要是Mn2+、Fe2+、Al3+,结合表中金属离子开始沉淀及沉淀完全时的pH,Fe2+沉淀完全pH是9.7,此时Mn2+已被沉淀部分,降低了MnO2的产率,加入MnO2,目的是使Fe2+被氧化成Fe3+,Fe3+和Al3+沉淀完全时的最低pH为5.0,该情况下Mn2+还未开始沉淀,结合流程可知电解液含Mn2+。
溶于硫酸,溶液中阳离子主要是Mn2+、Fe2+、Al3+,结合表中金属离子开始沉淀及沉淀完全时的pH,Fe2+沉淀完全pH是9.7,此时Mn2+已被沉淀部分,降低了MnO2的产率,加入MnO2,目的是使Fe2+被氧化成Fe3+,Fe3+和Al3+沉淀完全时的最低pH为5.0,该情况下Mn2+还未开始沉淀,结合流程可知电解液含Mn2+。
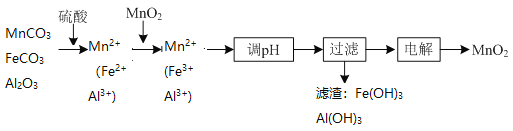
(1)①“酸浸”时MnCO3发生反应的离子方程式: MnCO3+2H+=Mn2++CO2↑ +H2O。
② “酸浸”过程中加入过量硫酸的目的还有:提高菱锰矿中锰元素的浸出率,或者说提高菱锰矿转化率。
③提高“酸浸”的速率,还可以采取的方法:适当升高温度、搅拌、将菱锰矿粉碎增大接触面积、适当增大酸的浓度等。
(2)由流程分析知Fe2+被MnO2氧化,根据氧化还原反应原理确定产物为Fe3+和Mn2+, 离子方程式:![]() 。
。
(3)杂质离子是Fe3+和Al3+ ,“调pH””的目的是使Fe3+和Al3+沉淀完全,pH最小5.0,但又不能使Mn2+开始沉淀,故pH小于7.8, “调pH”的范围应为5.0≤pH<7.8。
(4)当溶液中时Al3+沉淀完全, c(Al3+)≤10-5mol/L,此时pH=5.0,即c(H+)=1×10—5molL—1,c(OH—)=1×10—9molL—1,则Ksp[Al(OH)3] =c(Al3+)×c3(OH—)=![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
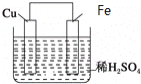
①Fe为正极,Cu为负极; ②H+向铁电极移动;③电子是由Fe经外电路流向Cu;④内电路电流由铁电极流向铜电极;⑤若有1mol电子流过导线,则产生的![]() 为
为![]() ;⑥负极的电极反应式为
;⑥负极的电极反应式为![]() 。
。
A.③④B.③⑤C.③④⑤D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求,用化学语言回答问题。
I.某有机物的实验式为C2H6O,用质谱仪测定其相对分子质量,经测定得到如图1所示的质谱图;最后用核磁共振仪处理该有机物,得到如图2所示的核磁共振氢谱图。

试回答下列问题:
(1)该有机化合物的相对分子质量为_______________。
(2)请写出该有机化合物的结构简式_______________。
II.化合物X是一种香料,可采用乙烯与甲苯为主要原料,按如图路线合成:

(1)写出由乙烯制取A的化学方程式:___________________________________________
(2)以乙烯为原料制得乙炔第二步反应的条件是________________________________
(3)写出B和D反应生成F的化学方程式:________________________________________
(4)写出C→D的化学方程式:__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
A. 右图表示反应①中的能量变化

B. 可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3等杂质)为原料制备金属铬的工艺流程如图所示:

(1)“焙烧”后所得固体为Na2CrO4、Fe2O3和NaAlO2。
①“焙烧”时FeO·Cr2O3发生反应的化学方程式为____。
②“焙烧”时Al2O3发生反应的化学方程式为____。
(2)“调pH=7”时生成Al(OH)3的离子方程式为____。
(3)“过滤”所得滤渣为Cr(OH)3,“还原”反应的离子方程式为____。
(4)“冶炼”时的化学方程式为____。
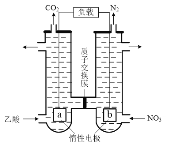
(5)含醋酸的酸性废水可用图2所示方法处理,写出负极的电极反应式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,稀释HA、HB两种酸溶液,溶液pH的变化曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积。下列说法正确的是( )

A.曲线上a、b两点![]() 的值一定相等
的值一定相等
B.pH 相同时,c(HA)>c(HB)
C.当lg![]() =6时,HA溶液的pH=8
=6时,HA溶液的pH=8
D.已知,酸的酸性越强,其对应钠盐的碱性越弱,则25℃时,NaA溶液的pH 一定小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)![]() 2NO(g) K1=1×10-30
2NO(g) K1=1×10-30
②2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
③2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法正确的是
A.NO分解反应NO(g)![]()
![]() N2(g)+
N2(g)+![]() O2(g)的平衡常数为1×10-30
O2(g)的平衡常数为1×10-30
B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2
D.温度升高,上述三个反应的平衡常数均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com