
【题目】如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
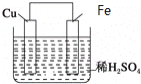
①Fe为正极,Cu为负极; ②H+向铁电极移动;③电子是由Fe经外电路流向Cu;④内电路电流由铁电极流向铜电极;⑤若有1mol电子流过导线,则产生的![]() 为
为![]() ;⑥负极的电极反应式为
;⑥负极的电极反应式为![]() 。
。
A.③④B.③⑤C.③④⑤D.③④⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。完成下列各题:
CH3OH(g)。完成下列各题:
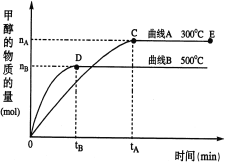
(1)反应达到平衡时,平衡常数表达式:K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,v(H2)= ;(用如图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填序号);
a.H2的浓度减少
b.CH3OH的物质的量增加
c.正反应速率加快,逆反应速率也加快
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关对定量实验误差分析正确的是( )
A. 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响
B. 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高
C. 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响
D. 现需90mL 1.0molL-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
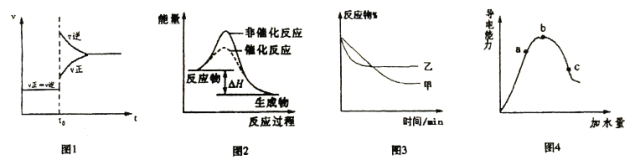
A.图1表示A(g)+B(g)![]() 3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示压强对可逆反应A(g)+B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
D.图4表示冰醋酸加水稀释,导电能力的变化图像,其中b点醋酸电高程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 往1mL 0.1mol/L AgNO3溶液中滴入2滴0.1 mol/L 的NaCl溶液,再往混合溶液中滴入2滴0.1 mol/L KI溶液,充分振荡 | 先产生白色沉淀,后出现黄色沉淀 | Ksp(AgCl) >Ksp (AgI) |
B | 一定条件下,密闭容器反应达平衡: H2(g)+I2(g) | 气体颜色加深 | 平衡逆移 |
C | 等体积、等pH的HA和HB两种酸溶液分别与足量的大小相同的锌反应 | 反应开始后HA产生H2的速率更快 | HA是弱酸 |
D | 向锌粒与稀硫酸反应的试管中滴加几滴CuSO4溶液 | 产生气体的速率明显加快 | CuSO4对该反应有催化作用 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
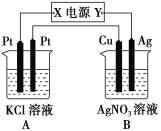
(1)电源电极X的名称为______(填“正极”或“负极”)。
(2)电解池B中阳极的电极反应式是:__________________________________________。
(3)若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16 g时A中溶液的pH=________(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复
到与电解前完全相同的状态,则应加入________(填物质的种类及物质的量)。
(4)当铜、银两电极的质量差为2.16 g时,A中生成的气体最多为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是

A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
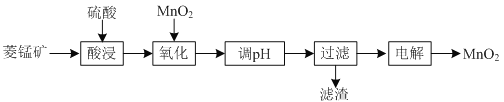
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com