
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法中正确的是
A.pH均为5的HCl和NH4Cl溶液中,两溶液中水的电离程度相同
B.常温下,在pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,所得溶液中一定存在c(A-)=c(Na+)>c(H+)=c(OH-)
C.等体积、等浓度的NaX溶液和弱酸HX溶液混合后的溶液中一定存在:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O![]() Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,各物质浓度随时间变化的关系如图所示。

(1)计算该反应的平衡常数K=____。反应进行到20 min时,再向容器内充入一定量NO2,10 min后达到新的平衡,此时测得c(NO2)=0.9 mol·L-1。
(2)第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1___w2(填“>”、“=”或“<”)。
(3)请在下图中画出20 min后各物质的浓度随时间变化的曲线___ (曲线上必须标出“X”和“Y”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:

回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
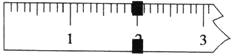
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。

按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
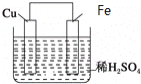
①Fe为正极,Cu为负极; ②H+向铁电极移动;③电子是由Fe经外电路流向Cu;④内电路电流由铁电极流向铜电极;⑤若有1mol电子流过导线,则产生的![]() 为
为![]() ;⑥负极的电极反应式为
;⑥负极的电极反应式为![]() 。
。
A.③④B.③⑤C.③④⑤D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以 H3AsO3 形式存在)含量极高,为控制砷的排放, 某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多 2 个电子层,砷在元素周期表的位置为_____。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反 应的离子方程式为_____。
(2)电镀厂的废水中含有的 CN-有剧毒,需要处理加以排放。处理含 CN-废水的方法之一是在 微生物的作用下,CN-被氧气氧化成 HCO3- ,同时生成 NH3,该反应的离子方程式为_____。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子, A―表示乳酸根离子):
①阳极的电极反应式为_____
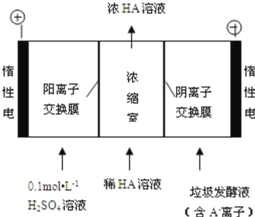
②电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的 OH-可忽略不 计。400 mL 10 g·L-1 乳酸溶液通电一段时间后, 浓度上升为 145 g/L(溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____L (已知:乳酸的摩尔质量为 90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):
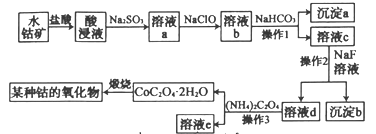
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1) 的系统名称为________________________________;
的系统名称为________________________________;
(2) 中含氧官能团的名称为___________、______________
中含氧官能团的名称为___________、______________
(3)反-3-甲基-3-己烯的结构简式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
A. 右图表示反应①中的能量变化

B. 可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C. 1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D. CH3OH转变成H2的过程一定要吸收能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com