
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:

回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
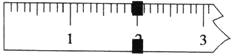
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。

按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
【答案】抑制Fe2+水解 Fe2++ H2C2O4![]() FeC2O4↓+2H+ 14.4 c 21.9 44.6% DCDBAD A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
FeC2O4↓+2H+ 14.4 c 21.9 44.6% DCDBAD A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
【解析】
(1) 步骤Ⅰ中:亚铁离子在水溶液中水解:Fe2++2H2O![]() Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解;
Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解;
在步骤I制备的溶液中加入25mL饱和H2C2O4溶液,搅拌并加热煮沸,晶体颗粒长大形成黄色FeC2O42H2O沉淀,离子方程式为Fe2++ H2C2O4![]() FeC2O4↓+2H+;
FeC2O4↓+2H+;
Fe2++ H2C2O4![]() FeC2O4↓+2H+的平衡常数K=
FeC2O4↓+2H+的平衡常数K=![]() ,
,
根据H2C2O4![]() H++ HC2O4-,HC2O4-
H++ HC2O4-,HC2O4-![]() H++ C2O42-,
H++ C2O42-,
K1=![]() ,K2=
,K2=![]()
根据的溶解平衡方程式:FeC2O4![]() Fe2++ C2O42-,Ksp(FeC2O4)=c(Fe2+)c (C2O42-),
Fe2++ C2O42-,Ksp(FeC2O4)=c(Fe2+)c (C2O42-),
可知,K=![]() =
=![]() =14.4,
=14.4,
故答案为:抑制Fe2+水解;Fe2++ H2C2O4![]() FeC2O4↓+2H+;14.4;
FeC2O4↓+2H+;14.4;
(2)为了不引入杂质,将FeC2O4氧化为K3[Fe(C2O4)3],最好需要双氧水,
故选选c;
(3)根据题意和图示,制得晶体的质量为21.9g;27.8gFeSO4·7H2O的物质的量为![]() =0.1mol,根据铁元素守恒,理论上可以生成0.1molK3[Fe(C2O4)3]·3H2O,质量为49.1g,K3[Fe(C2O4)3]·3H2O的产率为
=0.1mol,根据铁元素守恒,理论上可以生成0.1molK3[Fe(C2O4)3]·3H2O,质量为49.1g,K3[Fe(C2O4)3]·3H2O的产率为![]() ×100%=44.6%,
×100%=44.6%,
故答案为:21.9;44.6%;
(4)二氧化碳能够是澄清石灰水变浑浊,一氧化碳具有还原性,被氧化生成二氧化碳,因此首先检验二氧化碳,除净二氧化碳后再检验一氧化碳,从左到右,装置的连接顺序为DCDBAD,当看到第一个澄清石灰水变浑浊,证明有二氧化碳,当看到A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊,证明有一氧化碳,
故答案为:DCDBAD;A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,混合溶液的pH随滴入NaOH溶液体积的变化如图所示。下列说法错误的是( )
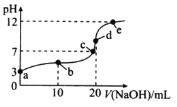
A.溶液导电性:e>d>c>b>a
B.水的电离程度:c>d>e>b>a
C.A-的水解常数:Kh≈10-9
D.b点溶液中存在![]() c(HA)=
c(HA)=![]() c(A-)+c(OH-)-c(H+)
c(A-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可以达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验亚硫酸钠是否变质 | 先将亚硫酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入 |
B | 除去苯中混有的苯酚 | 加入适量的溴水,充分反应后过滤,弃去沉淀 |
C | 除去NaCl晶体中混有 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
D | 检验 | 将 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
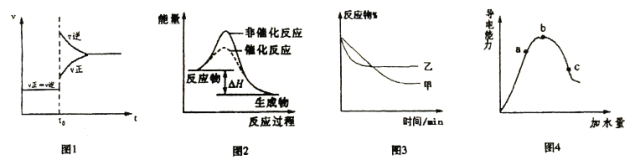
A.图1表示A(g)+B(g)![]() 3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示压强对可逆反应A(g)+B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
D.图4表示冰醋酸加水稀释,导电能力的变化图像,其中b点醋酸电高程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在0.5 L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。则下列结论正确的是

A. 10 s时反应生成了0.2 mol C
B. 该反应进行到10 s时,消耗了0.2 molA
C. 该反应的化学方程式为3A+B![]() 2C
2C
D. 10 s内用B表示的反应速率为0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
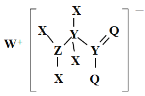
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO![]() 、SiO
、SiO![]() 、SO
、SO![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是( )
A. 溶液X中一定含有Na+、Cl-和SiO![]()
B. 溶液X中一定不含Ca2+、Br-
C. 为确定溶液X中是否含有SO![]() ,可取溶液2,加入BaCl2溶液
,可取溶液2,加入BaCl2溶液
D. 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com