
،¾جâؤ؟،؟½«ز»¶¨ء؟NO2؛حN2O4µؤ»ى؛دئّجهح¨بëجه»خھ1 Lµؤ؛مخآأـ±صبفئ÷ضذ£¬¸÷خïضتإ¨¶بثوت±¼ن±ن»¯µؤ¹طدµبçح¼ثùت¾،£

(1)¼ئثم¸أ·´س¦µؤئ½؛â³£تK£½____،£·´س¦½ّذذµ½20 minت±£¬شظدٍبفئ÷ؤع³نبëز»¶¨ء؟NO2,10 min؛َ´ïµ½ذآµؤئ½؛⣬´ثت±²âµأc(NO2)£½0.9 mol،¤L£1،£
(2)µعز»´خئ½؛âت±»ى؛دئّجهضذNO2µؤجه»·ضتخھw1£¬´ïµ½ذآئ½؛â؛َ»ى؛دئّجهضذNO2µؤجه»·ضتخھw2£¬شٍw1___w2(جî،°>،±،¢،°£½،±»ٍ،°<،±)،£
(3)اëشعدآح¼ضذ»³ِ20 min؛َ¸÷خïضتµؤإ¨¶بثوت±¼ن±ن»¯µؤاْدك___ (اْدكةد±طذë±ê³ِ،°X،±؛ح،°Y،±)،£

،¾´ً°¸،؟0.9 > 
،¾½âخِ،؟
سةح¼1؟ةضھ£¬X،¢Yµؤإ¨¶ب±ن»¯ء؟ض®±بخھ2£؛1£¬شٍXخھNO2،¢YخھN2O4£¬·¢ةْ·´س¦£؛N2O4£¨g£©![]() 2NO2£¨g£©£®
2NO2£¨g£©£®
£¨1£©ئ½؛âت±c£¨NO2£©=0.6mol،¤L£1،¢c£¨N2O4£©=0.4mol،¤L£1£¬´ْبëK=![]() ¼ئثم£»
¼ئثم£»
£¨2£©؛مخآ؛مبفدآ£¬شظ³نبëز»¶¨ء؟NO2£¬µبذ§خھشِ´َر¹ا؟£¬ئ½؛âؤودٍزئ¶¯£»
£¨3£©20minت±ث²¼نc£¨NO2£©شِ´َ£¬c£¨N2O4£©²»±ن£¬¶ّ؛َئ½؛âدٍؤو·´س¦·½دٍزئ¶¯£¬c£¨NO2£©¼ُذ،£¬c£¨N2O4£©شِ´َ£¬10min؛َ´ïµ½ذآµؤئ½؛⣬´ثت±²âµأc£¨NO2£©=0.9mol،¤L£1£¬¸ù¾فئ½؛â³£ت¼ئثمئ½؛âت±c£¨N2O4£©£¬¾ف´ث×÷ح¼،£
£¨1£©ئ½؛âت±c£¨NO2£©=0.6mol،¤L£1،¢c£¨N2O4£©=0.4mol،¤L£1£¬´ْبëK=![]() =
=![]() =0.9£»
=0.9£»
£¨2£©؛مخآ؛مبفدآ£¬شظ³نبëز»¶¨ء؟NO2£¬µبذ§خھشِ´َر¹ا؟£¬ئ½؛âؤودٍزئ¶¯£¬ذآئ½؛â؛َ»ى؛دئّجهضذNO2µؤجه»·ضت¼ُذ،£¬¹تW1£¾W2£»
£¨3£©20minت±ث²¼نc£¨NO2£©شِ´َ£¬c£¨N2O4£©²»±ن£¬¶ّ؛َئ½؛âدٍؤو·´س¦·½دٍزئ¶¯£¬c£¨NO2£©¼ُذ،£¬c£¨N2O4£©شِ´َ£¬10min؛َ´ïµ½ذآµؤئ½؛⣬´ثت±²âµأc£¨NO2£©=0.9mol،¤L£1£¬سةسعK=![]() ==0.9£¬شٍئ½؛âت±c£¨N2O4£©=
==0.9£¬شٍئ½؛âت±c£¨N2O4£©=![]() mol،¤L£1=0.9mol،¤L£1£¬¶ّXخھNO2،¢YخھN2O4£¬20min؛َ¸÷خïضتµؤإ¨¶بثوت±¼ن±ن»¯µؤاْدكخھ£؛
mol،¤L£1=0.9mol،¤L£1£¬¶ّXخھNO2،¢YخھN2O4£¬20min؛َ¸÷خïضتµؤإ¨¶بثوت±¼ن±ن»¯µؤاْدكخھ£؛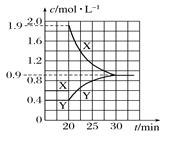 ،£
،£


 ؟ھذؤ؟ىہض¼ظئع×÷زµتî¼ظ×÷زµخ÷°²³ِ°وةçدµءذ´ً°¸
؟ھذؤ؟ىہض¼ظئع×÷زµتî¼ظ×÷زµخ÷°²³ِ°وةçدµءذ´ً°¸
| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟²»ح¬خآ¶بدآ£¬ث®بـز؛ضذc(H£«)سëc(OH£)µؤ¹طدµبçح¼ثùت¾،£دآءذسذ¹طثµ·¨²»صب·µؤتا( )
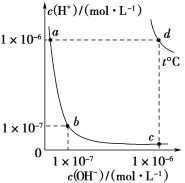
A.dµم¶شس¦µؤت³رخث®pH£½6£¬³تضذذش
B.aµم¶شس¦µؤد،ءٍثلسëcµم¶شس¦µؤCH3COONaبـز؛ضذث®µؤµçہë³ج¶بدàح¬
C.خآ¶بخھt ،وت±£¬0.05 mol،¤L£1 Ba(OH)2بـز؛µؤpH£½11
D.دٍaµم¶شس¦µؤCH3COOHبـز؛ضذµخ¼سNaOHبـز؛ضءbµم£¬´ثت±c(Na£«)£½c(CH3COO£)
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ؤ³ح¬ر§°´صص؟خ±¾تµرéزھاَ£¬سأ50mL0.50mol/Lµؤرخثلسع50mL0.55mol/LµؤNaOHبـز؛شعبçح¼ثùت¾µؤ×°ضأضذ½ّذذضذ؛ح·´س¦£¬ح¨¹²â¶¨·´س¦¹³جضذثù·إ³ِµؤببء؟¼ئثمضذ؛حبب£¬دآءذثµ·¨ضذ£¬صب·µؤتا£¨،،،،£©
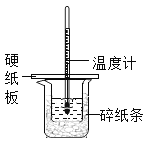
A. ةص±¼نجîآْثéض½جُµؤ×÷سأتا¹ج¶¨ذ،ةص±
B. سأبçح¼×°ضأ؟ةزشحê³ةضذ؛حبب²â¶¨µؤتµرé
C. خھ·ہض¹»ى؛دبـز؛ت±½¦³ِ²ْةْخَ²î£¬زٍ´ث»ى؛دت±ثظ¶بزھآ
D. بô½«رخثلجه»¸ؤخھ60mL£¬²»؟¼آاببء؟ثًت§£¬ہيآغةدثùاَضذ؛حببدàµب
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟°±تاضطزھµؤ¹¤زµشءد,شعإ©زµ،¢ز½ز©،¢¹ْ·ہ؛ح»¯¹¤µبءىسٍسذضطزھس¦سأ،£
I.£¨1£©¹¤زµةدسأN2؛حH2شعز»¶¨جُ¼دآ؛د³ة°±,دآءذ´ëت©ؤـت¹ص·´س¦ثظآتشِ´َ,ازت¹ئ½؛â»ى؛دخïضذNH3µؤجه»·ضتز»¶¨شِ´َµؤتا________،£
A.½µµح·´س¦خآ¶ب B.ر¹ثُ·´س¦»ى؛دخï C.³نبëN2 D.ز؛»¯·ضہëNH3
£¨2£©³£خآدآدٍ100mL0.2mo/Lµؤ°±ث®ضذضًµخ¼سبë0.2mol/Lµؤرخثل,ثùµأبـز؛µؤpH،¢بـز؛ضذNH4+؛حNH3،¤H2Oخïضتµؤء؟·ضتسë¼سبëرخثلµؤجه»µؤ¹طدµبçدآح¼ثùت¾,¸ù¾فح¼دٌ»ط´ًدآءذختجâ،£

¢ظ±يت¾NH3،¤H2Oإ¨¶ب±ن»¯µؤاْدكتا__________(جî،°A،±»ٍ،°B")،£
¢عNH3،¤H2Oµؤµçہë³£تخھ_______(زرضھlg1.8 = 0.26)،£
¢غµ±¼سبëرخثلجه»خھ50mlت±,بـ±»ضذc(NH4+)- c(NH3،¤H2O) =_____mol/L (سأت×ض±يت¾)،£
¢ٍ.بôز؛°±ضذز²´وشعہàثئث®µؤµçہë( H2O+H2O![]() H3O+ +OH-),ج¼ثلؤئبـسعز؛°±؛َز²ؤـ·¢ةْحêب«µçہë؛حہàثئث®½âµؤ°±½â،£
H3O+ +OH-),ج¼ثلؤئبـسعز؛°±؛َز²ؤـ·¢ةْحêب«µçہë؛حہàثئث®½âµؤ°±½â،£
£¨1£©ذ´³ِز؛°±µؤµçہë·½³جت½_________.
£¨2£©ذ´³ِج¼ثلؤئبـسعز؛°±؛َµعز»¼¶°±½âµؤہë×س·½³جت½__________
£¨3£©ذ´³ِج¼ثلؤئµؤز؛°±بـز؛ضذ¸÷ہë×سإ¨¶بµؤ´َذ،¹طدµ____________
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذسذ¹ط¶ش¶¨ء؟تµرéخَ²î·ضخِصب·µؤتا( )
A. ضذ؛حبب²â¶¨تµرéضذ£¬»؛آµط½«NaOHبـز؛µ¹بë²â¶¨×°ضأضذ--²â¶¨½ل¹ûخقس°دى
B. ثل¼îضذ؛حµخ¶¨تµرéضذ£¬µخ¶¨ا°خقئّإف¶ّµخ¶¨؛َسذئّإف_²â¶¨½ل¹ûئ«¸ك
C. ²â¶¨بـز؛pHµؤتµرéضذ£¬سأ¸ةشïpHتشض½²â¶¨ذآضئآبث®µؤpH--²â¶¨½ل¹ûخقس°دى
D. دضذè90mL 1.0molL-1NaOHبـز؛£¬³ئب،3.6gNaOH¹ججهإنضئ--بـز؛إ¨¶بئ«µح
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذتµرé·½°¸ضذ£¬؟ةزش´ïµ½تµرéؤ؟µؤµؤتا£¨،،،،£©
ر،دî | تµرéؤ؟µؤ | تµرé·½°¸ |
A | ¼ىرéراءٍثلؤئتا·ٌ±نضت | دب½«راءٍثلؤئرùئ·بـسعث®إن³ةبـز؛£¬ب»؛َ¼سبë×مء؟د،رخثلثل»¯£¬شظ¼سبë |
B | ³ب¥±½ضذ»ىسذµؤ±½·س | ¼سبëتتء؟µؤنهث®£¬³ن·ض·´س¦؛َ¹آث£¬ئْب¥³ءµي |
C | ³ب¥NaCl¾§جهضذ»ىسذ | دب½«¾§جهبـسعث®إن³ةبـز؛£¬ب»؛َصô·¢½ل¾§²¢³أبب¹آثئْب¥آثز؛ |
D | ¼ىرé | ½« |
A.AB.BC.CD.D
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذح¼ت¾سë¶شس¦µؤذًتِ²»دà·ûµؤتا
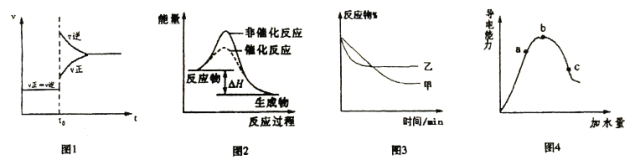
A.ح¼1±يت¾A(g)+B(g)![]() 3C(g)+2D(s) ،÷H<0£¬´ïµ½ئ½؛â؛َة¸كخآ¶ب³ةشِ´َر¹ا؟ت±µؤثظآت،ھت±¼ن±ن»¯ح¼دٌ
3C(g)+2D(s) ،÷H<0£¬´ïµ½ئ½؛â؛َة¸كخآ¶ب³ةشِ´َر¹ا؟ت±µؤثظآت،ھت±¼ن±ن»¯ح¼دٌ
B.ح¼2±يت¾ؤ³·إبب·´س¦·ض±ًشعسذ،¢خق´ك»¯¼ءµؤاé؟ِدآ·´س¦¹³جضذµؤؤـء؟±ن»¯
C.ح¼3±يت¾ر¹ا؟¶ش؟ةؤو·´س¦A(g)+B(g)![]() 3C(g)+D(s)µؤس°دى£¬ززµؤر¹ا؟´َ
3C(g)+D(s)µؤس°دى£¬ززµؤر¹ا؟´َ
D.ح¼4±يت¾±ù´×ثل¼سث®د،تح£¬µ¼µçؤـء¦µؤ±ن»¯ح¼دٌ£¬ئنضذbµم´×ثلµç¸ك³ج¶ب×î´َ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذتµرé²ظ×÷،¢دضدَ؛ح½لآغ¾ùصب·µؤتا
ر،دî | ²ظ×÷ | دضدَ | ½لآغ |
A | ¢ظ½«تھبَµؤ؛ىة«ت¯بïتشض½؟؟½üتش¹ـ؟ع
| تشض½²»±نة« |
|
B | ¢عضذصٌµ´؛َ¾²ضأ | دآ²مز؛جهرصة«±نا³ |
|
C | ¢غذ؟ھ»îبû | ¹غ²ىµ½؛ىة«إçبھ |
|
D | ¢ـ±ص؛د؟ھ¹طK£¬ذخ³ةشµç³ط | Zn¼«ةدسذ؛ىة«¹ججهخِ³ِ | ذ؟µؤ½ًتôذش±بحا؟ |
A.AB.BC.CD.D
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟زرضھشع1،ء105 Pa،¢298 Kجُ¼دآ£¬2 molاâئّب¼ةصةْ³ةث®صôئّ·إ³ِ484 kJببء؟£¬دآءذبب»¯ر§·½³جت½صب·µؤتا(،،،،)
A.H2O(g)= H2(g)£«![]() O2(g)،،¦¤H£½242 kJ،¤mol£1
O2(g)،،¦¤H£½242 kJ،¤mol£1
B.2H2(g)£«O2(g)= 2H2O(l)،،¦¤H£½£484 kJ،¤mol£1
C.H2(g)£«![]() O2(g)= H2O(g)،،¦¤H£½242 kJ،¤mol£1
O2(g)= H2O(g)،،¦¤H£½242 kJ،¤mol£1
D.2H2(g)£«O2(g)= 2H2O(g)،،¦¤H£½484 kJ،¤mol£1
²é؟´´ً°¸؛ح½âخِ>>
¹ْ¼تر§ذ£سإر، - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com