
【题目】下列有关电解质溶液的说法中正确的是
A.pH均为5的HCl和NH4Cl溶液中,两溶液中水的电离程度相同
B.常温下,在pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,所得溶液中一定存在c(A-)=c(Na+)>c(H+)=c(OH-)
C.等体积、等浓度的NaX溶液和弱酸HX溶液混合后的溶液中一定存在:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O![]() Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
【答案】B
【解析】
A项、HCl电离出氢离子抑制水的电离,NH4Cl在溶液中水解促进水的电离,两溶液中水的电离程度不同,故A错误;
B项、常温下,在pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,,则溶液中c(H+)=c(OH-),溶液中存在电荷守恒关系c(Na+)+c(H+)=c(OH-) + c(A-),则溶液中一定存在c(A-)=c(Na+)>c(H+)=c(OH-),故B正确;
C项、若等体积、等浓度的NaX溶液和弱酸HX溶液混合后溶液呈酸性,存在:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),若溶液呈碱性,存在: c(HX)>c(Na+)> c(X-) > c(OH-)> c(H+),故C错误;
D项、向浅绿色的Fe(NO3)2溶液中加入盐酸,NO3-在酸性环境下氧化Fe2+生成Fe3+,溶液变为黄色,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】已知:Fe(OH)3的Ksp=2.79×10-39,Al(OH)3的Ksp=1.3×10-31。现将20 mL 0.05 mol/L FeCl3和20 mL 0.05 mol/L AlCl3混合,再向溶液中逐滴加入0.10 mol/L NaOH溶液,测定溶液的pH变化如图所示,则下列说法不正确的是( )
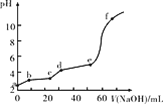
A.a点处,Al3+水解程度比Fe3+水解程度大
B.bc段主要产生Fe(OH)3沉淀
C.de段主要反应:Al3++3OH-=Al(OH)3↓
D.向f点所得溶液中通入足量CO2,沉淀的质量会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法不正确的是( )
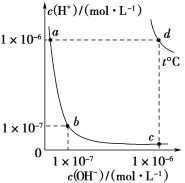
A.d点对应的食盐水pH=6,呈中性
B.a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
C.温度为t ℃时,0.05 mol·L-1 Ba(OH)2溶液的pH=11
D.向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,混合溶液的pH随滴入NaOH溶液体积的变化如图所示。下列说法错误的是( )
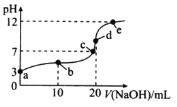
A.溶液导电性:e>d>c>b>a
B.水的电离程度:c>d>e>b>a
C.A-的水解常数:Kh≈10-9
D.b点溶液中存在![]() c(HA)=
c(HA)=![]() c(A-)+c(OH-)-c(H+)
c(A-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。完成下列各题:
CH3OH(g)。完成下列各题:
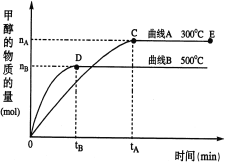
(1)反应达到平衡时,平衡常数表达式:K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,v(H2)= ;(用如图中出现的字母表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填序号);
a.H2的浓度减少
b.CH3OH的物质的量增加
c.正反应速率加快,逆反应速率也加快
d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,该滴定实验可使用的指示剂为___,达到滴定终点的现象为___。
(2)样品中氨的质量分数表达式为___。
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为___mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
Ⅱ.已知
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(4)则用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为___加入___调节pH为___(保留两位有效数字),铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
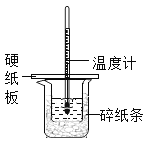
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是________。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
③当加入盐酸体积为50ml时,溶被中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com