
【题目】已知:Fe(OH)3的Ksp=2.79×10-39,Al(OH)3的Ksp=1.3×10-31。现将20 mL 0.05 mol/L FeCl3和20 mL 0.05 mol/L AlCl3混合,再向溶液中逐滴加入0.10 mol/L NaOH溶液,测定溶液的pH变化如图所示,则下列说法不正确的是( )
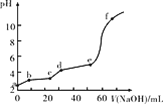
A.a点处,Al3+水解程度比Fe3+水解程度大
B.bc段主要产生Fe(OH)3沉淀
C.de段主要反应:Al3++3OH-=Al(OH)3↓
D.向f点所得溶液中通入足量CO2,沉淀的质量会变大
【答案】A
【解析】
Fe3+水解平衡Fe3++3H2OFe(OH)3+3H+,水解平衡常数Kh(Fe3+)=c3(H+)÷c(Fe3+)=K3w÷Ksp[Fe(OH)3],同理可得Kh(Al3+)=K3w÷Ksp[Al(OH)3]。
A.由于Ksp[Al(OH)3]>Ksp[Fe(OH)3],即Kh(Fe3+)>Kh(Al3+),故a点处Fe3+水解程度比Al3+水解程度大,故A错误;
B.随着NaOH溶液的滴加,Fe3+先沉淀,Al3+后沉淀,bc段主要产生Fe(OH)3沉淀,故B正确;
C.de段主要产生Al(OH)3沉淀,故C正确;
D.f点的pH>10,故Al(OH)3已经全部溶解生成AlO2,沉淀只为Fe(OH)3,此时若通入足量CO2,发生反应AlO2+CO2+2H2O=Al(OH)3↓+HCO3,重新生成Al(OH)3沉淀,碳酸酸性很弱,并不能溶解Fe(OH)3和Al(OH)3,则沉淀总质量增加,故D正确;
故选:A。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】已知前四周期A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E基态原子有6个未成对电子:
请填写下列空白:
(1)E元素在元素周期表的位置是______,E元素基态原子的价电子排布式为_____;
(2)C基态原子的价层电子的轨道表达式______;
(3)B2A4是重要的基本石油化工原料。1molB2A4分子中含_____molσ键;
(4)BD2电子式为_____,此分子键角为_______;
(5)BD32-中心原子孤电子对数为______,离子的立体构型为______;
(6)B、C、D三种元素的第一电离能由小到大的顺序为______(填元素符号),其原因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来流行喝苹果醋。苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:

下列相关说法正确的是( )
A. 苹果酸在一定条件下能发生消去反应
B. 苹果酸在一定条件下能催化氧化生成醛
C. 苹果酸在一定条件下能发生加聚反应生成高分子化合物
D. 1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
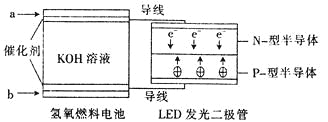
A.a处通人氧气,b处通人氢气
B.该装置中只涉及两种形式的能量转化
C.电池正极电极反应式为O2+2H2O+4e-﹦4OH-
D.P一型半导体连接的是电池负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中( )
H++S2-,若向H2S溶液中( )
A.加入硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,溶液酸性减弱
C.通入氯气,平衡向左移动,溶液酸性增强
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2![]() Fe2++SO42—
Fe2++SO42—![]() Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_______________________,第二步反应的离子方程式为________________。
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_______________________,第二步反应的离子方程式为________________。
(3)工业煤干馏得到的产品有焦炭、________。
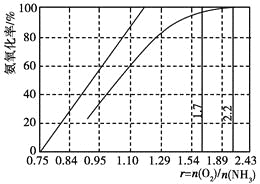
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.C6H5CH2CH2OH与C6H5OH互为同系物
B.CH3CHO与CH3COOH在一定条件下均能与新制氢氧化铜反应
C.![]() 与
与![]() 互为同分异构体
互为同分异构体
D.H2O与D2O互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)的性质,室温下进行以下两组实验:(已知:室温下,H2C2O4的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5)
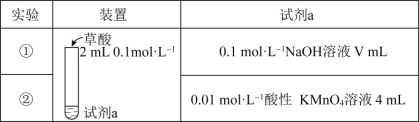
下列有关实验说法正确的是( )
A.若实验①中V=2,则混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若实验①中V=4,则混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.实验②反应的离子方程式为5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若实验②测得KMnO4溶液的褪色时间为40s,则这段时间内的平均反应速率v(KMnO4)=2.5×10-4molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法中正确的是
A.pH均为5的HCl和NH4Cl溶液中,两溶液中水的电离程度相同
B.常温下,在pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,所得溶液中一定存在c(A-)=c(Na+)>c(H+)=c(OH-)
C.等体积、等浓度的NaX溶液和弱酸HX溶液混合后的溶液中一定存在:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O![]() Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
Fe(OH)2+2H+,若在此溶液中加入盐酸, c(H+)增大,平衡左移,溶液的绿色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com