
【题目】已知前四周期A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E基态原子有6个未成对电子:
请填写下列空白:
(1)E元素在元素周期表的位置是______,E元素基态原子的价电子排布式为_____;
(2)C基态原子的价层电子的轨道表达式______;
(3)B2A4是重要的基本石油化工原料。1molB2A4分子中含_____molσ键;
(4)BD2电子式为_____,此分子键角为_______;
(5)BD32-中心原子孤电子对数为______,离子的立体构型为______;
(6)B、C、D三种元素的第一电离能由小到大的顺序为______(填元素符号),其原因为______。
【答案】第四周期第ⅥB族 3d54s1 ![]() 5
5 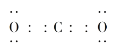 180o 0 平面三角形 C O N 同周期元素的第一电离能从左到右有增大的趋势,N原子2p轨道处于半充满状态,较稳定,其I1会出现反常
180o 0 平面三角形 C O N 同周期元素的第一电离能从左到右有增大的趋势,N原子2p轨道处于半充满状态,较稳定,其I1会出现反常
【解析】
前四周期A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为氢元素;B原子核外电子有6种不同的运动状态,则B原子核外有6个电子,则B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为![]() ,所以D为氧元素;C的原子序数介于碳、氧元素之间,则C为氮元素;E基态原子有6个未成对电子,只能是其中5个在d轨道,1个在s轨道,故E为铬元素,综上所述ABCDE依次为氢、碳、氮、氧、铬。
,所以D为氧元素;C的原子序数介于碳、氧元素之间,则C为氮元素;E基态原子有6个未成对电子,只能是其中5个在d轨道,1个在s轨道,故E为铬元素,综上所述ABCDE依次为氢、碳、氮、氧、铬。
(1)前四周期元素E基态原子有6个未成对电子推知E为铬元素,在元素周期表的位置是第四周期第ⅥB族;![]() 元素基态原子的价电子排布式为
元素基态原子的价电子排布式为![]() ,
,
故答案为:第四周期第ⅥB族;![]() ;
;
(2)C为氮元素,根据洪特规则,其基态原子的价层电子的轨道表达式为![]() ,
,
故答案为:![]() ;
;
(3)![]() 即
即![]() ,1个
,1个![]() 分子中含有5个σ键,1个π键,则lmol
分子中含有5个σ键,1个π键,则lmol![]() 分子中含有5molσ键,
分子中含有5molσ键,
答案为:5;
(4)![]() 即
即![]() 中,碳氧之间共用两对电子,电子式为:
中,碳氧之间共用两对电子,电子式为: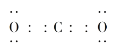 ,二氧化碳是直线型分子,键角为180 o
,二氧化碳是直线型分子,键角为180 o
故答案为: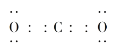 ;180 o ;
;180 o ;
(5)![]() 即
即![]() ,中心原子上的孤电子对数
,中心原子上的孤电子对数![]() ;
;![]() 的价电子对数是3,所以其空间构型是平面三角形,
的价电子对数是3,所以其空间构型是平面三角形,
故答案为:0;平面三角形;
(6)B、C、D依次为碳、氮、氧,同周期元素的第一电离能从左到右有增大的趋势,![]() 原子2p轨道处于半充满状态,较稳定,其I1会出现反常,在三种元素中最大,
原子2p轨道处于半充满状态,较稳定,其I1会出现反常,在三种元素中最大,
故答案为:![]()
![]()
![]() ;同周期元素的第一电离能从左到右有增大的趋势,
;同周期元素的第一电离能从左到右有增大的趋势,![]() 原子2p轨道处于半充满状态,较稳定,其I1会出现反常。
原子2p轨道处于半充满状态,较稳定,其I1会出现反常。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀性。如图所示为一种以镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)用离子方程式解释加入H2O2的作用:_________________。
(3)室温下滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。

(4)电解制备镍的反应原理如上图所示,则A电极的反应式为2H++2e-=H2↑和________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1molL-1和0.01molL-1的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色 | 原Fe(NO3)2中一定含有Fe3+ |
C | 向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 常温下,分别测量浓度均为0.1molL-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验现象的说法不正确的是

A. 氨气是无色有刺激性气味的气体,密度比空气小
B. 实验1,由喷泉现象可知氨气极易溶于水且溶解速率快
C. 实验1,烧瓶溶液中的含氮微粒有:NH3、NH3·H2O和NH4+
D. 实验2,加热过程中温度和c(NH3·H2O)对NH3·H2O电离平衡移动方向的影响一致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中![]()
![]() 的值减小
的值减小
B.中和滴定时,滴定管用所盛装的反应液润洗![]() 次
次
C.浓度均为![]() 的下列溶液,pH由大到小的排列顺序为:
的下列溶液,pH由大到小的排列顺序为:![]()
D.为确定HA是强酸还是弱酸,常温下可测![]() 溶液的pH:若
溶液的pH:若![]() ,则HA是弱酸;若
,则HA是弱酸;若![]() ,则HA是强酸
,则HA是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是

A. a=20,b=40,且溶液呈中性处于A、B两点之间
B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH![]() )
)
C. 已知lg3≈0.5,则C点的pH≈5
D. A、B、C三点中,B点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
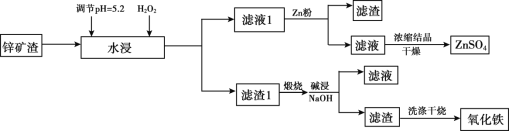
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
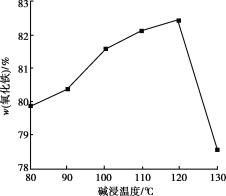
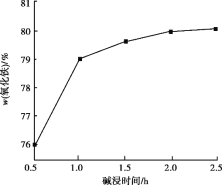
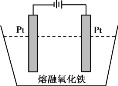
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe(OH)3的Ksp=2.79×10-39,Al(OH)3的Ksp=1.3×10-31。现将20 mL 0.05 mol/L FeCl3和20 mL 0.05 mol/L AlCl3混合,再向溶液中逐滴加入0.10 mol/L NaOH溶液,测定溶液的pH变化如图所示,则下列说法不正确的是( )
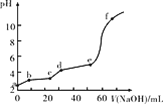
A.a点处,Al3+水解程度比Fe3+水解程度大
B.bc段主要产生Fe(OH)3沉淀
C.de段主要反应:Al3++3OH-=Al(OH)3↓
D.向f点所得溶液中通入足量CO2,沉淀的质量会变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com