
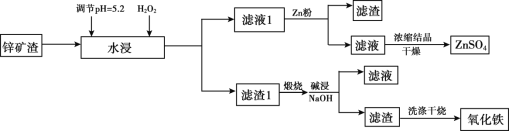
【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
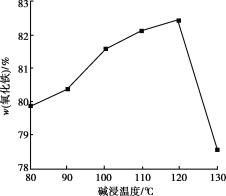
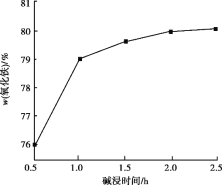
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
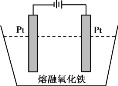
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。
【答案】氧化Fe2+为Fe(OH)3而沉淀 取少量滤液1于试管中,滴加KSCN溶液,若不显红色,则证明不含Fe3+ Zn+Cu2+= Zn2++Cu SiO2 、Fe(OH)3 、FeS2 SiO2+2OH-=SiO32-+H2O 120℃1h 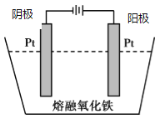 阴极:Fe3++3e-=Fe
阴极:Fe3++3e-=Fe
【解析】
锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4等,充分水浸,加入过氧化氢可将亚铁离子氧化,调节溶液pH=5.2可生成氢氧化铁沉淀,过滤,滤液1主要含有ZnSO4、CuSO4,加入锌粉置换出铜,滤液经蒸发浓缩可得硫酸锌;滤渣1主要含有SiO2、Fe(OH)3、FeS2(题目所给信息:FeS2不溶于水和稀酸),煅烧时发生反应4FeS2+11O2  2Fe2O3+8SO2、2Fe(OH)3
2Fe2O3+8SO2、2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O![]() ;煅烧后加入氢氧化钠溶液碱浸,SiO2与氢氧化钠溶液反应,可生成硅酸钠形成溶液,过滤得到的滤渣则主要为氧化铁,洗涤干燥后得到氧化铁,以此解答该题。
;煅烧后加入氢氧化钠溶液碱浸,SiO2与氢氧化钠溶液反应,可生成硅酸钠形成溶液,过滤得到的滤渣则主要为氧化铁,洗涤干燥后得到氧化铁,以此解答该题。
(1)加入H2O2,调节pH,可氧化Fe2+为Fe(OH)3而沉淀,故答案为:氧化Fe2+为Fe(OH)3而沉淀;
(2)铁离子与KSCN反应,检验滤液1中不含Fe3+的方法是取少量滤液1于试管中,滴加KSCN溶液,若不显红色,则证明不含Fe3+,滤液1加入锌粉可置换出铜,发生Zn+Cu2+=Zn2++Cu,
故答案为:取少量滤液1于试管中,滴加KSCN溶液,若不显红色,则证明不含Fe3+;Zn+Cu2+=Zn2++Cu;
(3)由以上分析可知滤渣1为SiO2、Fe(OH)3、FeS2,加入NaOH碱浸时反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2、Fe(OH)3、FeS2;SiO2+2OH-=SiO32-+H2O;
(4)由图象可知,温度为120℃时氧化铁的含量最高,碱浸1h时氧化铁含量较高,且之后上升不明显,故答案为:120℃、1h;
(5)电解时,氧离子向阳极移动,铁离子向阴极移动,阴极发生还原反应生成铁,电极反应式为Fe3++3e-=Fe,图象可表示为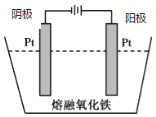 ,
,
故答案为: ;Fe3++3e-=Fe。
;Fe3++3e-=Fe。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是

A.NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H2O2做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
A.①②③B.③④⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知前四周期A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E基态原子有6个未成对电子:
请填写下列空白:
(1)E元素在元素周期表的位置是______,E元素基态原子的价电子排布式为_____;
(2)C基态原子的价层电子的轨道表达式______;
(3)B2A4是重要的基本石油化工原料。1molB2A4分子中含_____molσ键;
(4)BD2电子式为_____,此分子键角为_______;
(5)BD32-中心原子孤电子对数为______,离子的立体构型为______;
(6)B、C、D三种元素的第一电离能由小到大的顺序为______(填元素符号),其原因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.常温下,![]() 的碱性溶液中不可能存在
的碱性溶液中不可能存在![]() 分子
分子
B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
C.![]() 溶液加水稀释,溶液的pH和
溶液加水稀释,溶液的pH和![]() 的电离度均增大
的电离度均增大
D.将![]() 溶液滴入含酚酞的
溶液滴入含酚酞的![]() 溶液,红色褪去,说明
溶液,红色褪去,说明![]() 溶液显酸性
溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的Na2CO3溶液中,下列关系式正确的是( )
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来流行喝苹果醋。苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:

下列相关说法正确的是( )
A. 苹果酸在一定条件下能发生消去反应
B. 苹果酸在一定条件下能催化氧化生成醛
C. 苹果酸在一定条件下能发生加聚反应生成高分子化合物
D. 1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.C6H5CH2CH2OH与C6H5OH互为同系物
B.CH3CHO与CH3COOH在一定条件下均能与新制氢氧化铜反应
C.![]() 与
与![]() 互为同分异构体
互为同分异构体
D.H2O与D2O互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com