
【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀性。如图所示为一种以镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)用离子方程式解释加入H2O2的作用:_________________。
(3)室温下滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。

(4)电解制备镍的反应原理如上图所示,则A电极的反应式为2H++2e-=H2↑和________________________。
【答案】SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O 3 7 Ni2+和Fe2+不能分离 Ni2++2e-=Ni
【解析】
将废料酸溶,废料中的Fe、Ni元素均以+2价离子的形式存在,二氧化硅不溶于稀硫酸,故滤渣1为二氧化硅,而后为了分离Fe2+、Ni2+,要先将亚铁离子氧化为+3价,而后沉淀除去,进而进行后续操作。
(1)废料中只有二氧化硅不溶于稀硫酸,故滤渣1为SiO2;
(2)加入过氧化氢,可将亚铁离子氧化为+3价,方便后续的沉淀操作,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)铁刚好沉淀完全,此时![]() ,那么
,那么![]() ,pOH=11,pH=3;Ni开始沉淀,
,pOH=11,pH=3;Ni开始沉淀,![]() ,pOH=7,则pH=7;若上述过程中没有“氧化”步骤,其后果是无法将Ni2+和Fe2+分离开;
,pOH=7,则pH=7;若上述过程中没有“氧化”步骤,其后果是无法将Ni2+和Fe2+分离开;
(4)根据电解的目的以及A电极的反应式知,A电极上发生得电子的还原反应,则A电极上还有镍离子放电,电极反应式为Ni2++2e-=Ni。


科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为___;若该烯烃与足量的H2加成后生成分子为含3个甲基的烷烃A,则该烯烃可能的结构简式为___(任写其中一种)。若A的一种同分异构体B常温常压下为气体,一氯代物只有一种结构,B的二氯代物有___种。0.5molB的二氯代物最多可与___molCl2在光照条件下发生取代反应。
(2)有机物C的结构简式为![]() ,若C的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,写出C的该种同分异构体的结构简式___,用系统命名法命名为___。
,若C的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,写出C的该种同分异构体的结构简式___,用系统命名法命名为___。
(3)烯烃D是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,D分子中能够共平面的碳原子个数最多为___个,D使溴的四氯化碳溶液褪色的反应类型是___,产物的结构简式为___;一定条件下D能发生加聚反应,写出其化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨![]() 可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是
可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是

A.①转化中![]() 是还原剂
是还原剂
B.③中发生反应后溶液的pH减少
C.![]() 可处理水中
可处理水中![]()
D.工业上也可使用![]() 处理锅炉水中的溶解氧
处理锅炉水中的溶解氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、Al、O、N、S、Fe是常见的六种元素。
(1)S位于元素周期表______周期第______族,Fe的基态原子核外价电子排布式为______;O的基态原子核外有______种运动状态不同的电子。
(2)用“>”“<”或“=”填空
第一电离能 | 氧化性 | 沸点 | 非金属性 |
N______S | Fe3+______ Al3+ | NH3______H2O | 16O______18O |
(3)已知:下列两个热化学方程式:
4Fe(s)+302(g)=2Fe2O3(s)△H=﹣a kJ/mol
4Al(s)+3O2(g)=2Al2O3(s)△H=﹣b kJ/mol
则Al(s)的单质和Fe2O3(s)反应的热化学方程式是______。
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平氧化还原反应方程式:____________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]()
(2)称取6.0g含![]() 、
、![]() 和
和![]() 的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20.00ml时,溶液由无色变为浅红色。该溶液被中和的![]() 的总物质的量为____mol。
的总物质的量为____mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液。
A.![]() 溶液在滴定过程中作_____
溶液在滴定过程中作_____![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() ,该滴定过程___
,该滴定过程___![]() 填“需要”或“不需要”
填“需要”或“不需要”![]() 另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
C.若在达到滴定终点时俯视读数,则所得结果_____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
③原试样中![]() 的质量分数为______,
的质量分数为______,![]() 的质量分数为_____。
的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某一反应体系有反应物和生成物共五种物质:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 已知该反应中
已知该反应中![]() 只发生如下过程:
只发生如下过程:![]()
(1)该反应中的还原剂是_____________。
(2)写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目:_____________
(3)上述反应中每生成![]() 升氧气
升氧气![]() 标准状况
标准状况![]() ,转移电子数是_________________。
,转移电子数是_________________。
Ⅱ四氧化三铁![]() 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备![]() 纳米颗粒的反应是
纳米颗粒的反应是![]() x
x![]() 。请回答下列问题。
。请回答下列问题。
(4)水热法制备![]() 纳米颗粒的反应中,还原剂是____________。
纳米颗粒的反应中,还原剂是____________。
(5)反应的化学方程式中x![]() ________。
________。
(6)每生成![]() ,反应转移的电子为________mol,被
,反应转移的电子为________mol,被![]() 还原的
还原的![]() 的物质的量为________mol。
的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是

A.NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H2O2做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物显得尤为重要。
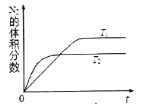
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) ![]() 2NO(g)的△H______0(填“>”或“<”)。
2NO(g)的△H______0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=_______________。该温度下,若增大压强此反应的平衡常数将______(填“增大”“减小”“不变”“无法确定”)若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
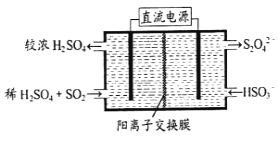
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将含a molCH3COOH的醋酸溶液与含b molBa(OH)2的氢氧化钡溶液混合,充分反应后,溶液呈中性,则醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知前四周期A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E基态原子有6个未成对电子:
请填写下列空白:
(1)E元素在元素周期表的位置是______,E元素基态原子的价电子排布式为_____;
(2)C基态原子的价层电子的轨道表达式______;
(3)B2A4是重要的基本石油化工原料。1molB2A4分子中含_____molσ键;
(4)BD2电子式为_____,此分子键角为_______;
(5)BD32-中心原子孤电子对数为______,离子的立体构型为______;
(6)B、C、D三种元素的第一电离能由小到大的顺序为______(填元素符号),其原因为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com