
【题目】联氨![]() 可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是
可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是

A.①转化中![]() 是还原剂
是还原剂
B.③中发生反应后溶液的pH减少
C.![]() 可处理水中
可处理水中![]()
D.工业上也可使用![]() 处理锅炉水中的溶解氧
处理锅炉水中的溶解氧
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为______。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
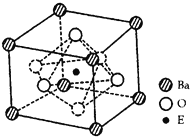
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为________
在该晶体中,E4+的氧配为数为____________。若该晶胞边长为a nm可 计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L 盐酸滴入20.00 mL 1.000 mol/L 氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
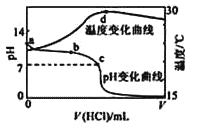
A.a 点由水电离出的c(H+)=1.0 × 10-14 mol/L
B.b 点c (NH4+) + c (NH3H2O) >c (Cl-)
C.c 点:c(Cl-)=c(NH4+)
D.d 点后,溶液温度略有下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是 ( )

A. N4属于一种新型的化合物B. N4分子中存在极性键
C. N4分子中N—N键角为109°28′D. 1 mol N4转变成N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的相对分子质量为136,分子式为C8H8O2。A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱和核磁共振氢谱如下图。下列关于A的说法中不正确的是

A. 与A属于同类化合物的同分异构体只有4种
B. 符合题中A分子结构特征的有机物只有1种
C. A在一定条件下可与3 molH2发生加成反应
D. A分子属于酯类化合物,在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀性。如图所示为一种以镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)用离子方程式解释加入H2O2的作用:_________________。
(3)室温下滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。

(4)电解制备镍的反应原理如上图所示,则A电极的反应式为2H++2e-=H2↑和________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1molL-1和0.01molL-1的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色 | 原Fe(NO3)2中一定含有Fe3+ |
C | 向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 常温下,分别测量浓度均为0.1molL-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com