
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应A(s)+B(g)C(g)+D(g)的化学平衡常数和温度的关系如表:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列说法正确的是( )
A.该反应为吸热反应
B.该反应的化学平衡常数表达式为K= ![]()
C.其他条件不变时,增大体系的压强,化学平衡常数减小
D.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
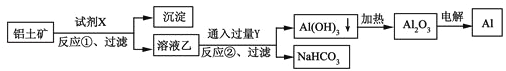
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示),
△H3═(用△H1、△H2表示);根据反应③判断△S0(填“>”、“=”或“<”),在(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.降低温度
E.使用合适的催化剂
F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL﹣1、0.3molL﹣1、0.3molL﹣1、0.15molL﹣1 , 则此时v正v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是 . 
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧元素的质量在数值上等于氧气摩尔质量的是( )
A. 22.4 L氧气 B. 阿伏加德罗常数个氧原子
C. 0.032 kg氧气 D. 1 mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是________。在该反应中________元素的化合价升高,该元素的原子________电子,被________;该反应中,________是氧化剂,________是氧化产物;氧化剂与还原剂的物质的量之比为___________;用双线桥标出该反应中电子转移的方向和数目_______________。
Al2O3+2Fe所属基本反应类型是________。在该反应中________元素的化合价升高,该元素的原子________电子,被________;该反应中,________是氧化剂,________是氧化产物;氧化剂与还原剂的物质的量之比为___________;用双线桥标出该反应中电子转移的方向和数目_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A.0.3 mol·L1的Na2SO4溶液中含有Na+和![]() 的总物质的量为0.9 mol
的总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和![]() 的物质的量相等,则K+和Cl的物质的量浓度一定相等
的物质的量相等,则K+和Cl的物质的量浓度一定相等
D.10 ℃时,0.35 mol·L1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
(1)部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01molL﹣1)溶液的PH和原子序数的关系如图所示. 
(i)元素R在周期表中的位置是
(ii)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(iii)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
(2)短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(i)下列能说明碳、硫两种元素非金属性相对强弱的是(填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(ii)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如图:
已知A是一种正盐,则反应I的化学反应方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com