
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示),
△H3═(用△H1、△H2表示);根据反应③判断△S0(填“>”、“=”或“<”),在(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.降低温度
E.使用合适的催化剂
F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL﹣1、0.3molL﹣1、0.3molL﹣1、0.15molL﹣1 , 则此时v正v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是 . 
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线. 
【答案】
(1)吸热
(2)K1×K2;△H1+△H2;<;较低
(3)ADF
(4)<
(5)AD
(6)解: 
【解析】解:(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应,
所以答案是:吸热;(2)反应①+②可得反应③,则平衡常数K3=K1×K2 , 反应③是气体体积减小的反应△S<0,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2 , 计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.52×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,所以反应在低温下能自发进行,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;所以△H3═△H1+△H2;
所以答案是:K1×K2;△H3═△H1+△H2;<;较低;(3)A.缩小反应容器的容积,缩小反应容器的容积,压强增大,平衡向正向移动,故正确;
B.扩大反应容器的容积,扩大反应容器的容积,压强减小,平衡逆向移动,故错误;
C.由于K3=K1×K2 , 由表中数据可知,升高温度平衡常数减小,平衡逆向移动,故错误;
D.由于K3=K1×K2 , 由表中数据可知,降低温度平衡常数增大,平衡正向移动,故正确;
E.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故错误;
F.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故正确,
故选:ADF;(4)500℃时K3=K1×K2=2.5,浓度商Qc= ![]() =16>K=2.5,反应向逆反应进行,故v(正)<v(逆),
=16>K=2.5,反应向逆反应进行,故v(正)<v(逆),
所以答案是:<;(5)A、反应②已经平衡常数随温度变化分析为吸热反应,反应物能量低于生成物,图象符合,故A正确;
B、催化剂改变反应速率不改变化学平衡,平衡状态不变,图象不符合,故B错误;
C、①2H2(g)+CO(g)CH3OH(g),依据数据分析,平衡常数随温度 升高减小,说明正反应为放热反应,反应物能量高于生成物,图象不符合,故C错误;
D、反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是放热盐,反应物能量高于生成物,图象符合,故D正确;
所以答案是:AD;(6)反应②CO2(g)+H2(g)CO(g)+H2O(g)是气体体积不变的吸热反应,反应的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,逆反应速率增大,t1时平衡,t2时降压,逆反应速率减小,平衡不变,t3时增加CO浓度,此时刻逆反应速率增大,随反应进行减小,大平衡状态大于t2﹣t3平衡状态的逆反应速率,t4时又达到平衡,依据反应速率影响分析绘制出去下变化;画出t2至t4的曲线为如图所示 ;
;
所以答案是:  .
.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢气的制取、储存和利用一直是化学领域研究的热点.H2O热分解可以得到H2和O2 , 高温下水分解体系中主要气体的体积分数与温度的关系如图所示.下列有关说法正确的是( ) 
A.图中A,B表示的粒子依次是O和H
B.图中A,B表示的粒子依次是H+和O2﹣
C.图中A,B重新生成水时的活化能等于0
D.图中A,B重新生成水时的活化能大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO(g)+Cl2(g)2ClNO(g)△H<0
写出该反应的平衡常数表达式 .
为研究不同条件对反应的影响,:在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应达到平衡.测得10min内v(ClNO)=7.5×10﹣3 molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K(填“增大”“减小”或“不变”).若要使K减小,可采取的措施是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 5 mol氢 B. 氢氧根离子的摩尔质量为17 g
C. 0.1 mol H 2 O分子约含6.02×10 22 个分子 D. 氩气的摩尔质量在数值上等于它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化…将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因.某研究小组研究某地硫酸酸雨的形成,有人提出以下猜想: 猜想一:SO2 ![]() SO3
SO3 ![]()
![]()
猜想二:S02 ![]()
![]()
![]()
![]()
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是( )
A.若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
B.若存在猜想二的过程,则该雨水可能使品红褪色
C.若只存在猜想一的过程,则该雨水的pH随时间延长而增大
D.上述任意一个猜想正确,该地区雨水的pH均小于5.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
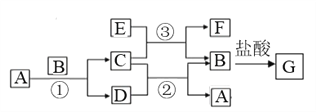
(1)C的俗名_____________,E与足量盐酸反应的离子方程式_________________;
(2)反应③化学方程式_______________________;E加入NaOH溶液中反应的离子反应方程式_______________________;
(3)检验G溶液中金属阳离子的方法________________________;
(4)F与氢氧化钠反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别甲烷、乙烯、乙炔三种气体可采用的方法是( )
A.通入溴水中,观察溴水是否褪色
B.通入酸性高锰酸钾溶液中,观察颜色变化
C.点燃,检验燃烧产物
D.点燃,观察火焰明亮程度及产生黑烟量的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中,纵坐标为沉淀量,横坐标为某溶液中加入的反应物的物质的量,选择合适图象对应的字母填空. 
(1)AlCl3溶液中加入氨水至过量 .
(2)AlCl3溶液中加入NaOH溶液至过量 .
(3)AlCl3、MgCl2混合溶液中加入NaOH溶液至过量 .
(4)澄清石灰水中通入过量CO2 .
(5)含有少量盐酸的AlCl3溶液中加入过量NaOH溶液 .
(6)含有少量HCl的AlCl3溶液中加入过量氨水 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com