
����Ŀ����ijһ��Ӧ��ϵ�з�Ӧ��������ﹲ�������ʣ�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��֪�÷�Ӧ��
��֪�÷�Ӧ��![]() ֻ�������¹��̣�
ֻ�������¹��̣�![]()
(1)�÷�Ӧ�еĻ�ԭ����_____________��
(2)д���÷�Ӧ�Ļ�ѧ����ʽ�����õ����ŷ��������ת�Ƶķ������Ŀ��_____________
(3)������Ӧ��ÿ����![]() ������
������![]() ��״��
��״��![]() ��ת�Ƶ�������_________________��
��ת�Ƶ�������_________________��
������������![]() �����������ȶ���������������;�㷺�����ٴ���ϡ����\���ͻ�����ѧ�������DZ��Ӧ�õ��������ߡ�ˮ�ȷ��Ʊ�
�����������ȶ���������������;�㷺�����ٴ���ϡ����\���ͻ�����ѧ�������DZ��Ӧ�õ��������ߡ�ˮ�ȷ��Ʊ�![]() �������ķ�Ӧ��
�������ķ�Ӧ��![]() x
x![]() ����ش��������⡣
����ش��������⡣
(4)ˮ�ȷ��Ʊ�![]() �������ķ�Ӧ�У���ԭ����____________��
�������ķ�Ӧ�У���ԭ����____________��
(5)��Ӧ�Ļ�ѧ����ʽ��x![]() ________��
________��
(6)ÿ����![]() ����Ӧת�Ƶĵ���Ϊ________mol����
����Ӧת�Ƶĵ���Ϊ________mol����![]() ��ԭ��
��ԭ��![]() �����ʵ���Ϊ________mol��
�����ʵ���Ϊ________mol��
���𰸡�![]()
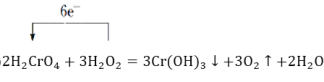
![]()
![]()
![]()
![]()
![]()
![]()
��������
![]() ��Ԫ�صĻ��ϼ���
��Ԫ�صĻ��ϼ���![]() ������Ϊ0�ۣ��ɴ˿�ȷ���÷�Ӧ�Ļ�ԭ����
������Ϊ0�ۣ��ɴ˿�ȷ���÷�Ӧ�Ļ�ԭ����
![]() H2CrO4�ڷ�Ӧ�еõ�������Cr(OH)3�����(1)�з������ɴ˿�д����Ӧ�ķ���ʽ��
H2CrO4�ڷ�Ӧ�еõ�������Cr(OH)3�����(1)�з������ɴ˿�д����Ӧ�ķ���ʽ��
![]() ������Ӧ������
������Ӧ������![]() ������
������![]() ��״��
��״��![]() ��O��-1����Ϊ0�ۣ�������ת�Ƶ�������
��O��-1����Ϊ0�ۣ�������ת�Ƶ�������
![]() �ɵ���غ�ó�
�ɵ���غ�ó�![]() ����Ӧ����ʽ
����Ӧ����ʽ![]() ,�ɴ˿�ȷ����ԭ����
,�ɴ˿�ȷ����ԭ����
![]() �����ѵó�xֵ��
�����ѵó�xֵ��
![]() ÿ����
ÿ����![]() ���μӷ�Ӧ��������Ϊ
���μӷ�Ӧ��������Ϊ![]() ����0�۱�Ϊ
����0�۱�Ϊ![]() �ۣ���Ӧת�Ƶĵ���Ϊ4mol������
�ۣ���Ӧת�Ƶĵ���Ϊ4mol������![]() ��ԭ��
��ԭ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]() ���ɴ˿������
���ɴ˿������![]() ��ԭ��
��ԭ��![]() �����ʵ�����
�����ʵ�����
![]() ��Ԫ�صĻ��ϼ���
��Ԫ�صĻ��ϼ���![]() ������Ϊ0�ۣ����Ը÷�Ӧ�еĻ�ԭ����
������Ϊ0�ۣ����Ը÷�Ӧ�еĻ�ԭ����![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
![]() H2CrO4�ڷ�Ӧ�еõ�������Cr(OH)3��������ӦΪ2H2CrO4+3H2O2=2Cr(OH)3��+3O2��+2H2O�����õ����ŷ��������ת�Ƶķ������Ŀ��
H2CrO4�ڷ�Ӧ�еõ�������Cr(OH)3��������ӦΪ2H2CrO4+3H2O2=2Cr(OH)3��+3O2��+2H2O�����õ����ŷ��������ת�Ƶķ������Ŀ��![]()
���ʴ�Ϊ��![]() ��
��
![]() ������Ӧ��ÿ����
������Ӧ��ÿ����![]() ������
������![]() ��״��
��״��![]() ��ת�Ƶ�������0.3NA���ʴ�Ϊ��0.3NA��
��ת�Ƶ�������0.3NA���ʴ�Ϊ��0.3NA��
![]() �ɵ���غ�ó�
�ɵ���غ�ó�![]() ������ӦΪ
������ӦΪ![]() ,ˮ�ȷ��Ʊ�
,ˮ�ȷ��Ʊ�![]() �������ķ�Ӧ�У������ϼ����ߣ����Ի�ԭ����
�������ķ�Ӧ�У������ϼ����ߣ����Ի�ԭ����![]() ��
��![]() ���ʴ�Ϊ��Fe2+��S2O32-��
���ʴ�Ϊ��Fe2+��S2O32-��
![]() ��Ӧ�Ļ�ѧ����ʽ��
��Ӧ�Ļ�ѧ����ʽ��![]() ���ʴ�Ϊ��4��
���ʴ�Ϊ��4��
![]() ÿ����
ÿ����![]() ���μӷ�Ӧ��������Ϊ
���μӷ�Ӧ��������Ϊ![]() ����0�۱�Ϊ
����0�۱�Ϊ![]() �ۣ���Ӧת�Ƶĵ���Ϊ4mol������
�ۣ���Ӧת�Ƶĵ���Ϊ4mol������![]() ��ԭ��
��ԭ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]() ����
����![]() ��ԭ��
��ԭ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]() ���ʴ�Ϊ��4��0.5��
���ʴ�Ϊ��4��0.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܼ��仯�����Ӧ�����������ء�������Ⱦ�ϵȡ�
(1)CoO��һ���������Ӽ�����ͨ����Ӧ�٢��Ʊ���
��2Co(s)+O2(g)=2CoO(s) ��H1=akJ��mol-1
��2CoCO3(s) =CoO(s) + CO2 (g) ��H2=akJ��mol-1
��Ӧ2Co(s)+O2(g)+2CO2(g)=2CoO3(s) �Ħ�H=_________��
(2)ij﮵�صĵ���ʿɴ���Li+����ط�ӦʽΪ��LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
�ٵ�طŵ�ʱ�������ĵ缫��ӦʽΪ_________��Li+��______�ƶ��������������������
��һ�ֻ��յ缫��CoԪ�صķ����ǣ���LiCoO2��H2O2��H2SO4��Ӧ����CoSO4���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
(3)BASF��ѹ���Ʊ��������������ѭ��������ͼ-1��ʾ����ѭ�����ܷ�Ӧ����ʽΪ_________________(��Ӧ���������г�)

(4)ij���ܴ�����ͬʱ��ȥ�����ͳ�β���е�̼��(C)��NOx����ͬ�¶��£���10molģ��β�����ɷ���������ʾ������ͬ������ͨ���ô�����������в���(CO2��N2��N2O)��NO��������ݽ����ͼ-2��ʾ.
ģ��β�� | ���� | ̼�� | ||
NO | O2 | He | ||
���������������������� | 0.25% | 5% | 94.75% | a mol |

��380��ʱ������ų��������к�0.45 mol O2��0.0525 mol CO2����Y�Ļ�ѧʽΪ__________________��
��ʵ������в���NOģ��NOx,����������NO2��ԭ����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ʒ�ˮ��ʹ��NaCN��������0.5 mg/L�����ɴﵽ�ŷű�����Ӧ���������С���һ��NaCN��NaClO��Ӧ������NaOCN��NaCl���ڶ���NaOCN��NaClO��Ӧ������Na2CO3��CO2��NaCl��N2����֪HCN�����ᣬ�ӷ����о綾��HCN��HOCN��NԪ�صĻ��ϼ���ͬ������˵����ȷ����
A. ����NaCN�����Ʒ�ˮ�Ĺ�������Ԫ�ػ��ϼ۵ĸı�
B. ��һ����Ӧ��ҺӦ����Ϊ���ԣ��ɱ��������ж�����HCN
C. �ڶ��������ķ�ӦΪ2OCN�� + 3ClO�� ![]() 2CO2�� + CO32 + 3Cl�� + N2��
2CO2�� + CO32 + 3Cl�� + N2��
D. ����100 m3��NaCN 10.3 mg/L�ķ�ˮʵ��������Ҫ50 mol NaClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܻ�����Ҫ�������ϵ����ܼ���Ҳ����Ϊũҩ���塢������ͻ�ױƷ�ȵ�ԭ�ϡ������ܻ���(DBP)�ɸ��ưƵ����ϵĿڸУ��������涨�����������������˺�����ϳ���·ͼ��ͼI��ʾ�� ��֪������Ϣ��
��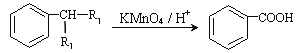
��R1CHO+R2CH2CHO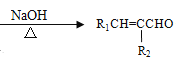 +H2O
+H2O
��CΪ������̼ԭ�ӵ����ĺ����������˴Ź�������ͼ��ͼ��ʾ
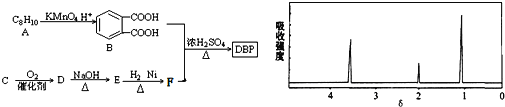
�����������Ϣ�ش��������⣺
(1)C�Ľṹ��ʽΪ____________�� E�����������ŵ�������____________��
(2)д�������йط�Ӧ�Ļ�ѧ����ʽ��
��E��H2�����ʵ�����1�U1��Ӧ����F��______________________��
��B��F�����ʵ�����1�U2�ϳ�DBP��_____________________���÷�Ӧ�ķ�Ӧ����Ϊ_____________________��
(3)ͬʱ��������������B��ͬ���칹����______�֣�д��������������ͬ���칹��Ľṹ��ʽ_________________��
�ٲ��ܺ�NaHCO3��Һ��Ӧ ���ܷ���������Ӧ
����FeCl3��Һ����ɫ �ܺ˴Ź���������ʾ������ֻ��һ����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӳ������չ�Բ����������ԣ��ܹ��߶�ĥ��Ϳ���ʴ�ԡ���ͼ��ʾΪһ���������ϣ���Ҫ��NiO��������FeO��SiO2�����ʣ��Ʊ�Ni�����̣�

��֪����������������ܶȻ��������±���
������ | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10-15 | 10-15 | 10-38 |
(1)����1����Ҫ�ɷ�Ϊ_____________(�ѧʽ)��
(2)�����ӷ���ʽ���ͼ���H2O2�����ã�_________________��
(3)�����µμӰ�ˮ������pHΪ_________ʱ�����պó�����ȫ���������μӰ�ˮ��pHΪ_____________ʱ������ʼ�������ٶ�Ni2+Ũ��Ϊ0.lmol/L)��������������û�������������裬������_______________��

(4)����Ʊ����ķ�Ӧԭ������ͼ��ʾ����A�缫�ķ�ӦʽΪ2H++2e-=H2����________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������![]() �����ڴ�����¯ˮ�е��ܽ�������ֹ��¯����ʴ������һ�ַ�Ӧ������ͼ��ʾ�����������������
�����ڴ�����¯ˮ�е��ܽ�������ֹ��¯����ʴ������һ�ַ�Ӧ������ͼ��ʾ�����������������
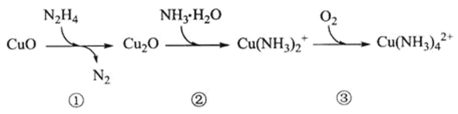
A.��ת����![]() �ǻ�ԭ��
�ǻ�ԭ��
B.���з�����Ӧ����Һ��pH����
C.![]() �ɴ���ˮ��
�ɴ���ˮ��![]()
D.��ҵ��Ҳ��ʹ��![]() ������¯ˮ�е��ܽ���
������¯ˮ�е��ܽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������![]() ��һ�ֹ��ס���Ч����������������ˮ��������ˮ�����ȷ����й㷺Ӧ�ã�������ijУ��ѧ�о�С�����ʵ������ȡ
��һ�ֹ��ס���Ч����������������ˮ��������ˮ�����ȷ����й㷺Ӧ�ã�������ijУ��ѧ�о�С�����ʵ������ȡ![]() �Ĺ�������ͼ�������й�˵����ȷ����
�Ĺ�������ͼ�������й�˵����ȷ����
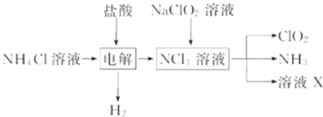
A.���ʱ������Ӧ�Ļ�ѧ����ʽΪ��2HCl![]() Cl2
Cl2![]() +H2
+H2![]()
B.��NaClO2��Һ��ȡ0.6molClO2ʱ����������0.1molNCl3
C.�������Ļ������ͨ��ʢ�м�ʯ�ҵĸ������Գ�ȥClO2�е�NH3
D.��ҺX�ijɷ�ΪNaClO2��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���![]() ��Һ����μ���
��Һ����μ���![]() ��Һ�������Һ��pH��KOH��Һ�ļ���仯�����ͼ�����н��۴������( )
��Һ�������Һ��pH��KOH��Һ�ļ���仯�����ͼ�����н��۴������( )
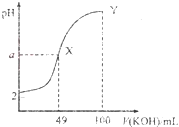
A.������![]() mLKOH��Һʱ��������Һ��ˮ�ĵ���̶ȴ���X����Һ��ˮ�ĵ���̶�
mLKOH��Һʱ��������Һ��ˮ�ĵ���̶ȴ���X����Һ��ˮ�ĵ���̶�
B.HAΪ���ᣬ�����£�Ka��������Ϊ![]()
C.Y���Ӧ����Һ�У�![]()
D.����KOH��Һ�ζ�HA��Һ����ѡ�ü�����ָʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�CH3COOH��NH3��H2O�ĵ��볣����Ϊ1.8��10��5����20 mLŨ�Ⱦ�Ϊ0.1 mol/L NaOH��NH3��H2O�Ļ��Һ�еμӵ����ʵ���Ũ�ȵ�CH3COOH��Һ�����û��Һ�ĵ����������CH3COOH��Һ�������V���Ĺ�ϵ��ͼ��ʾ������˵������ȷ����

A. a=20��b=40������Һ�����Դ���A��B����֮��
B. B����Һ�У�c(CH3COO��)��c(Na��)��c(NH![]() ��
��
C. ��֪lg3��0.5����C���pH��5
D. A��B��C�����У�B����Һ��ˮ�ĵ���̶����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com