
【题目】常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
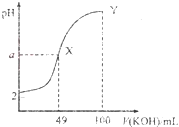
A.当加入![]() mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
B.HA为弱酸,常温下,Ka的数量级为![]()
C.Y点对应的溶液中:![]()
D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______。
(2)在1mol DC2中,有___mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____(填元素符号),三种10e-的化合物中沸点最低的___。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________。
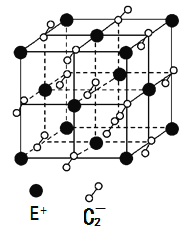
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某一反应体系有反应物和生成物共五种物质:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 已知该反应中
已知该反应中![]() 只发生如下过程:
只发生如下过程:![]()
(1)该反应中的还原剂是_____________。
(2)写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目:_____________
(3)上述反应中每生成![]() 升氧气
升氧气![]() 标准状况
标准状况![]() ,转移电子数是_________________。
,转移电子数是_________________。
Ⅱ四氧化三铁![]() 磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备![]() 纳米颗粒的反应是
纳米颗粒的反应是![]() x
x![]() 。请回答下列问题。
。请回答下列问题。
(4)水热法制备![]() 纳米颗粒的反应中,还原剂是____________。
纳米颗粒的反应中,还原剂是____________。
(5)反应的化学方程式中x![]() ________。
________。
(6)每生成![]() ,反应转移的电子为________mol,被
,反应转移的电子为________mol,被![]() 还原的
还原的![]() 的物质的量为________mol。
的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响,结果如表所示
废水处理的影响,结果如表所示![]() 的起始浓度、体积、电压、电解时间均相同
的起始浓度、体积、电压、电解时间均相同![]() 。下列说法错误的是
。下列说法错误的是 ![]()
![]()
实验 |
|
|
|
|
|
是否加入 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极材料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
| 0.092% | 12.7% | 20.8% | 57.3% | 实验 |
A.实验![]() 与实验
与实验![]() 对比,其他条件不变,增加
对比,其他条件不变,增加![]() 有利于
有利于![]() 的去除
的去除
B.实验![]() 与实验
与实验![]() 对比,其他条件不变,增加
对比,其他条件不变,增加![]() 有利于
有利于![]() 的去除
的去除
C.实验![]() 中
中![]() 循环利用提高了
循环利用提高了![]() 的去除率
的去除率
D.若实验![]() 中去除
中去除![]() ,电路中共转移0.06mol电子
,电路中共转移0.06mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物显得尤为重要。
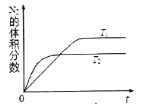
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) ![]() 2NO(g)的△H______0(填“>”或“<”)。
2NO(g)的△H______0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=_______________。该温度下,若增大压强此反应的平衡常数将______(填“增大”“减小”“不变”“无法确定”)若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
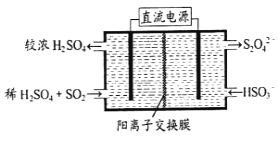
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将含a molCH3COOH的醋酸溶液与含b molBa(OH)2的氢氧化钡溶液混合,充分反应后,溶液呈中性,则醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)T ℃时,在1 L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C的浓度随时间t的变化如图所示。该反应的化学方程式为______。在2分钟内用A的浓度变化表示的平均反应速率为____mol·L-1·min-1。

(2)一定条件下,上述反应达到化学平衡状态的标志是_____(填字母)。
A.v(正)=v(逆)=0
B.各物质的浓度不再变化
C.单位时间内消耗1 mol A,同时生成3 mol B
(3)若该反应放出热量,升高温度时,化学反应速率____(填“增大”或“减小”),平衡向_____(填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于滴定实验的下列说法正确的是
A.在酸碱中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化
B.用NaOH标准溶液滴定未知浓度的盐酸,到达终点时发现滴定管尖嘴部分有悬滴,会使测定结果偏小
C.用![]() 标准溶液滴定草酸时,
标准溶液滴定草酸时,![]() 标准溶液盛装在碱式滴定管中
标准溶液盛装在碱式滴定管中
D.所有的滴定实验都需加入指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值.下列说法正确的是( )
为阿伏伽德罗常数的值.下列说法正确的是( )
A.2L![]() 亚硫酸溶液中含有的
亚硫酸溶液中含有的![]() 离子数为
离子数为![]()
B.室温下,1L![]() 的NaOH溶液中,由水电离的
的NaOH溶液中,由水电离的![]() 离子数目为
离子数目为![]()
C.标准状况下,46g![]() 气体的分子数为
气体的分子数为![]()
D.某密闭容器中盛有![]()
![]() 和
和![]()
![]() ,在一定条件下充分反应,转移电子的数目小于
,在一定条件下充分反应,转移电子的数目小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填空.
(1)如图是常见仪器的部分结构。
A.  B.
B. ![]() C.
C.  D.
D. 
①写出仪器名称:B_____,C______。
②使用前需检查是否漏水的仪器有______________。(填仪器标号)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____,滴定终点时,锥形瓶中颜色变化为_______,且半分钟内颜色不复原。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______。
A .酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B .滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C .酸式滴定管在滴定前有气泡,滴定后气泡消失
D .读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
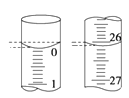
(5)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度______。(保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com