
【题目】(1)T ℃时,在1 L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C的浓度随时间t的变化如图所示。该反应的化学方程式为______。在2分钟内用A的浓度变化表示的平均反应速率为____mol·L-1·min-1。

(2)一定条件下,上述反应达到化学平衡状态的标志是_____(填字母)。
A.v(正)=v(逆)=0
B.各物质的浓度不再变化
C.单位时间内消耗1 mol A,同时生成3 mol B
(3)若该反应放出热量,升高温度时,化学反应速率____(填“增大”或“减小”),平衡向_____(填“正”或“逆”)反应方向移动。
【答案】3A(g)+B(g)![]() 2C(g) 1.5 B 增大 逆
2C(g) 1.5 B 增大 逆
【解析】
(1)最终反应物A、B的物质的量不变且不为0,属于可逆反应,而物质的量变化量之比等于化学计量数之比;根据v=![]() 计算;
计算;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(3)升高温度时,化学反应速率加快;对放热反应,升高温度,平衡向吸热的方向移动。
(1)最终反应物A、B的物质的量不变且不为0,属于可逆反应,A、B、C的化学计量数之比为(6-3)mol:(4-3)mol:2mol=3:1:2,故反应方程式为:3A(g)+B(g)![]() 2C(g) ;
2C(g) ;
v(A)=![]() =
=![]() =1.5mol·L-1·min-1;
=1.5mol·L-1·min-1;
(2)A.v(正)=v(逆)不等于0,故A错误;
B.各物质的浓度不再变化,说明已经达到平衡状态,故B正确;
C.单位时间内消耗1 mol A,同时生成3 mol B,速率比不等于计量数之比,故C 错误;
故选B。
(3)若该反应放出热量,升高温度时,反应混合物分子能量提高,化学反应速率增大,平衡向吸热的方向移动,即向逆反应方向移动。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.塑料、合成纤维和合成橡胶被称为“三大合成材料”
C.用甘氨酸(H2N-CH2-COOH)和苯丙氨酸(![]() )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨![]() 可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是
可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是
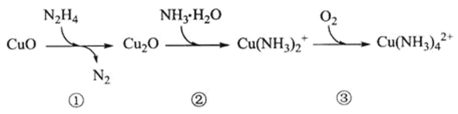
A.①转化中![]() 是还原剂
是还原剂
B.③中发生反应后溶液的pH减少
C.![]() 可处理水中
可处理水中![]()
D.工业上也可使用![]() 处理锅炉水中的溶解氧
处理锅炉水中的溶解氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝土矿![]() 主要成分为
主要成分为![]() ,含
,含![]() 杂质
杂质![]() 为原料冶炼铝的工艺流程如下:下列叙述正确的是
为原料冶炼铝的工艺流程如下:下列叙述正确的是![]()
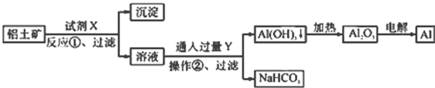
A.试剂X可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.操作②中发生的化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
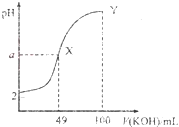
A.当加入![]() mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
B.HA为弱酸,常温下,Ka的数量级为![]()
C.Y点对应的溶液中:![]()
D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1molL-1CH3COOH溶液中加入少量水,溶液中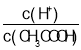 减小
减小
B.向0.1molL-1的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
C.向一定浓度的醋酸溶液中加水稀释,则溶液中 增大
增大
D.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,![]() 不断增大
不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 下,弱电解质的电离平衡常数
下,弱电解质的电离平衡常数![]() ,下列说法正确的是
,下列说法正确的是
A.用![]() 的盐酸滴定
的盐酸滴定![]() 的氨水时,可用酚酞作指示剂
的氨水时,可用酚酞作指示剂
B.![]() 的醋酸与
的醋酸与![]() 的氢氧化钠溶液等体积混合,所得溶液中:
的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.pH相同的![]() 、
、![]() 的两种溶液的
的两种溶液的![]() :
:![]()
D.![]() 的醋酸与
的醋酸与![]() 的氨水等体积混合,所得溶液中由水电离出的
的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。
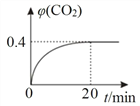
②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是_____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是_______。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是__;反应Ⅲ的化学方程式为________________。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是_________________________。
② 滴定过程中,至少须平行测定两次的原因是________________________。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为__________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com