
【题目】用铝土矿![]() 主要成分为
主要成分为![]() ,含
,含![]() 杂质
杂质![]() 为原料冶炼铝的工艺流程如下:下列叙述正确的是
为原料冶炼铝的工艺流程如下:下列叙述正确的是![]()
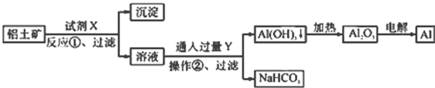
A.试剂X可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.操作②中发生的化学方程式为![]()
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。
已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;④Z基态原子有六个未成对电子。用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为____________________。
(2)Q元素在元素周期表中属于____区,与Y元素同族的第四周期元素的价电子排布式为______。
(3)RY2的电子式为________________,Z3+的离子结构示意图为____________。
(4) 由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质。该反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol·L-1
D. 反应开始时,乙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响,结果如表所示
废水处理的影响,结果如表所示![]() 的起始浓度、体积、电压、电解时间均相同
的起始浓度、体积、电压、电解时间均相同![]() 。下列说法错误的是
。下列说法错误的是 ![]()
![]()
实验 |
|
|
|
|
|
是否加入 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极材料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
| 0.092% | 12.7% | 20.8% | 57.3% | 实验 |
A.实验![]() 与实验
与实验![]() 对比,其他条件不变,增加
对比,其他条件不变,增加![]() 有利于
有利于![]() 的去除
的去除
B.实验![]() 与实验
与实验![]() 对比,其他条件不变,增加
对比,其他条件不变,增加![]() 有利于
有利于![]() 的去除
的去除
C.实验![]() 中
中![]() 循环利用提高了
循环利用提高了![]() 的去除率
的去除率
D.若实验![]() 中去除
中去除![]() ,电路中共转移0.06mol电子
,电路中共转移0.06mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明崇祯年间《徐光启手迹》记载了《造强水法》 :“绿钒(FeSO47H2O)五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,次用铁作锅,…… 锅下起火,取气冷定,开坛则药化为水……。用水入五金皆成水,惟黄金不化水中,加盐则化。……强水用过无力……”。下列有关解释错误的是
A.“将矾炒去,约折五分之一”后生成FeSO44H2O
B.该方法所造“强水”为硝酸
C.“惟黄金不化水中,加盐则化”的原因是加人 NaCl溶液后氧化性增强
D.“强水用过无力”的原因是“强水”用过以后,生成了硝酸盐溶液,其氧化性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)T ℃时,在1 L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C的浓度随时间t的变化如图所示。该反应的化学方程式为______。在2分钟内用A的浓度变化表示的平均反应速率为____mol·L-1·min-1。

(2)一定条件下,上述反应达到化学平衡状态的标志是_____(填字母)。
A.v(正)=v(逆)=0
B.各物质的浓度不再变化
C.单位时间内消耗1 mol A,同时生成3 mol B
(3)若该反应放出热量,升高温度时,化学反应速率____(填“增大”或“减小”),平衡向_____(填“正”或“逆”)反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com