
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
【答案】AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=c(Ag+)
Ag+(aq)+Cl-(aq) Ksp=c(Ag+)![]() c(Cl-) 减少 ③ c(Na+)>c(CN-)>c(OH-)>c(H+) HCO3-+H2O
c(Cl-) 减少 ③ c(Na+)>c(CN-)>c(OH-)>c(H+) HCO3-+H2O![]() H2CO3-+ OH-; 2.5
H2CO3-+ OH-; 2.5![]() 10-8 0.02 CN-+CO2+H2O=HCN+HCO3-
10-8 0.02 CN-+CO2+H2O=HCN+HCO3-
【解析】
(1)由对应酸的电离平衡常数酸性CH3COOH> H2CO3 > HCN > HCO3 -,酸性越弱对应盐的水解程度越大,溶液的碱性最强,判断则溶液碱性的强弱;
(2)根据NaCN溶液中CN-离子水解,溶液显碱性判断溶液中离子浓度的大小;
(3)根据水解常数为Kh=![]() 关系进行计算。
关系进行计算。
(1)AgCl属于难溶性强电解质,溶于水形成饱和溶液存在着AgCl沉淀溶解平衡,其沉淀溶解平衡方程式为AgCl(s)![]() Ag+(aq)+Cl-(aq); 沉淀溶解平衡常数Ksp=c(Ag+)
Ag+(aq)+Cl-(aq); 沉淀溶解平衡常数Ksp=c(Ag+)![]() c(Cl-);答案:AgCl(s)
c(Cl-);答案:AgCl(s)![]() Ag+(aq)+Cl-(aq); Ksp=c(Ag+)
Ag+(aq)+Cl-(aq); Ksp=c(Ag+)![]() c(Cl-);
c(Cl-);
(2)温度不变,Ksp不变,向该饱和AgCl溶液中加入NaCl固体,c(Cl-)增大,根据Ksp=c(Ag+)![]() c(Cl-),则C(Ag+)减少;答案:减少;
c(Cl-),则C(Ag+)减少;答案:减少;
(二)(1)由对应酸的电离平衡常数分析可知:酸性CH3COOH> H2CO3 > HCN > HCO3 -,酸性越弱对应盐的水解程度越大,溶液的碱性最强,则溶液中碱性②NaOH溶液>①NaCN溶液>④NaHCO3溶液>③CH3COONa溶液,这4种溶液pH最小的是: ③CH3COONa溶液;答案:③;
(2) NaCN溶液中CN-离子水解,溶液显碱性,溶液中离子浓度大小为:c(Na+)> c(CN-)> c(OH- )> c(H+);答案:c(Na+)> c(CN-)> c(OH- )> c(H+);
(3)④为NaHCO3溶液,弱根离子为HCO3-,发生水解反应的方程式为HCO3-+H2O![]() H2CO3-+ OH-;答案:HCO3-+H2O
H2CO3-+ OH-;答案:HCO3-+H2O![]() H2CO3-+ OH-;
H2CO3-+ OH-;
④NaHCO3溶液中碳酸氢根离子水解, HCO3-+H2O![]() H2CO3-+ OH-,水解常数为Kh= [c(OH-)
H2CO3-+ OH-,水解常数为Kh= [c(OH-)![]() c(H2CO3) ]/ c( HCO3- )=
c(H2CO3) ]/ c( HCO3- )=![]() =
=![]() =2.5
=2.5![]() 10-8;故答案为: HCO3-+H2O
10-8;故答案为: HCO3-+H2O![]() H2CO3-+ OH-;2.5
H2CO3-+ OH-;2.5![]() 10-8;
10-8;
(4)25°C时,测得HCN和NaCN的混合溶 液的pH= 11,![]() =
=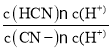 =
=![]() =
=![]() =0.02; 碳酸的一级电离常数大于HCN的电离常数,二级电离常数小于HCN的电离常数,故碳酸的酸性强于HCN,为碳酸氢根的酸性溶于HCN, 故向NaCN溶液中通入少量CO2,反应生成HCN与NaHCO3,该反应离子方程式为: CN-+CO2+H2O=HCN+HCO3-故答案为: 0.02 ; CN-+CO2+H2O=HCN+HCO3-。
=0.02; 碳酸的一级电离常数大于HCN的电离常数,二级电离常数小于HCN的电离常数,故碳酸的酸性强于HCN,为碳酸氢根的酸性溶于HCN, 故向NaCN溶液中通入少量CO2,反应生成HCN与NaHCO3,该反应离子方程式为: CN-+CO2+H2O=HCN+HCO3-故答案为: 0.02 ; CN-+CO2+H2O=HCN+HCO3-。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】用铝土矿![]() 主要成分为
主要成分为![]() ,含
,含![]() 杂质
杂质![]() 为原料冶炼铝的工艺流程如下:下列叙述正确的是
为原料冶炼铝的工艺流程如下:下列叙述正确的是![]()
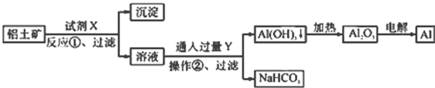
A.试剂X可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.操作②中发生的化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。
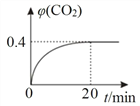
②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)。
4NO(g) + 6H2O(g)。
(1)升高温度,反应的平衡常数K值减小,则该反应的焓变△H_____0(填“>”、“<”或“=”)。
(2)下列能说明上述反应已达到平衡状态__________(填序号)
A.NH3的浓度不随时间变化
B.v正(O2)= v逆(NO)
C.体系的分子总数不再变化
D.单位时间内消耗4molNH3的同时生成6molH2O
(3)若其他条件不变,下列关系图错误的是______(选填序号)。
A.  B.
B.  C.
C.  D.
D. 
(4)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2 min | 3.2 | 0.8 | 1.2 | |
第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
①上表中空白处应填的数字为______。
②反应在第 2 min 到第 4 min 时,反应速率v(O2)=___________。
③反应在第 2 min 时改变了条件,改变的条件可能______;该条件下,反应的平衡常数K=_______(只写计算结果,不标单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是_____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是_______。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是__;反应Ⅲ的化学方程式为________________。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是_________________________。
② 滴定过程中,至少须平行测定两次的原因是________________________。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为__________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
![]()
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为_______________。
②蒸馏不能分离环己酮和水的原因是_______________。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分; b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4固体,除去有机物中的少量水。
①上述操作的正确顺序是________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需__________。
③在上述操作c中,加入NaCl 固体的作用是____________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有___种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000molL-1NaOH溶液分别滴定20.00mL浓度均为0.1000molL-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是( )
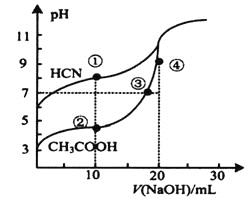
A.点①时:c(HCN)>c(Na+)>c(CN-)>c(OH-)
B.点②时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-)
C.c(CH3COOH)+c(CH3COO-)+c(Na+)的值:③点等于④点
D.恰好完全中和时,将两种溶液混合后:c(HCN)+c(CH3COOH)>c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com