
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
【答案】C
【解析】
A.饱和FeS溶液中存在沉淀溶解平衡,FeS(s)Fe2+(aq)+S2-(aq),加入少量Na2S固体溶解后硫离子浓度增大,平衡逆向进行,有浑浊出现,故A正确;
B.FeS的溶度积大于CuS的溶度积,除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂,故B正确;
C.Ksp(Mg(OH)2)=c(Mg2+)·c2(OH-)=1.8×10-11,c(OH-)=![]() ,Ksp(Fe(OH)3)= c(Fe3+)·c3(OH-)=4.0×10-38,c(OH-)=
,Ksp(Fe(OH)3)= c(Fe3+)·c3(OH-)=4.0×10-38,c(OH-)=![]() =
=![]() ×10-9mol/L,则氢氧化铁沉淀所需pH小于氢氧化镁,则先生成氢氧化铁沉淀,故C错误;
×10-9mol/L,则氢氧化铁沉淀所需pH小于氢氧化镁,则先生成氢氧化铁沉淀,故C错误;
D.向1mL 0.1 molL-1MgCl2溶液中滴加2mL0.1molL-1 NaOH溶液,恰好反应生成氢氧化镁沉淀, 饱和溶液中存在氢氧化镁的沉淀溶解平衡,取澄清溶液滴加2滴0.1molL-1 FeCl3溶液,会生成氢氧化铁沉淀有浑浊出现,故D正确;
故选:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用电解法处理含![]() 的废水,探究不同因素对含
的废水,探究不同因素对含![]() 废水处理的影响,结果如表所示
废水处理的影响,结果如表所示![]() 的起始浓度、体积、电压、电解时间均相同
的起始浓度、体积、电压、电解时间均相同![]() 。下列说法错误的是
。下列说法错误的是 ![]()
![]()
实验 |
|
|
|
|
|
是否加入 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极材料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
| 0.092% | 12.7% | 20.8% | 57.3% | 实验 |
A.实验![]() 与实验
与实验![]() 对比,其他条件不变,增加
对比,其他条件不变,增加![]() 有利于
有利于![]() 的去除
的去除
B.实验![]() 与实验
与实验![]() 对比,其他条件不变,增加
对比,其他条件不变,增加![]() 有利于
有利于![]() 的去除
的去除
C.实验![]() 中
中![]() 循环利用提高了
循环利用提高了![]() 的去除率
的去除率
D.若实验![]() 中去除
中去除![]() ,电路中共转移0.06mol电子
,电路中共转移0.06mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值.下列说法正确的是( )
为阿伏伽德罗常数的值.下列说法正确的是( )
A.2L![]() 亚硫酸溶液中含有的
亚硫酸溶液中含有的![]() 离子数为
离子数为![]()
B.室温下,1L![]() 的NaOH溶液中,由水电离的
的NaOH溶液中,由水电离的![]() 离子数目为
离子数目为![]()
C.标准状况下,46g![]() 气体的分子数为
气体的分子数为![]()
D.某密闭容器中盛有![]()
![]() 和
和![]()
![]() ,在一定条件下充分反应,转移电子的数目小于
,在一定条件下充分反应,转移电子的数目小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN是一种剧毒性的酸,常温下,0.10molL-1HCN溶液的pH = 3,下列说法正确的是( )
A.HCN是一种强酸
B.相同浓度的NaCl溶液与NaCN溶液,前者的pH更大
C.在NaCN溶液中存在:c(Na+) = c(HCN) + c(CN-)
D.中和相同体积与浓度的HCl溶液与HCN溶液,所消耗的NaOH溶液的体积不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的Na2CO3溶液中,下列关系式正确的是( )
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填空.
(1)如图是常见仪器的部分结构。
A.  B.
B. ![]() C.
C.  D.
D. 
①写出仪器名称:B_____,C______。
②使用前需检查是否漏水的仪器有______________。(填仪器标号)
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____,滴定终点时,锥形瓶中颜色变化为_______,且半分钟内颜色不复原。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______。
A .酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B .滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C .酸式滴定管在滴定前有气泡,滴定后气泡消失
D .读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
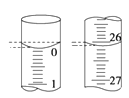
(5)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度______。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物A,有香味。A在酸性条件下水解生成有机物B和C。B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应,能催化氧化生成醛或酮。则A可能的结构有几种( )
A.4B.5C.6D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强碱溶液中加热R﹣Br 容易水解为R﹣OH.某芳香烃A有如下转化关系:
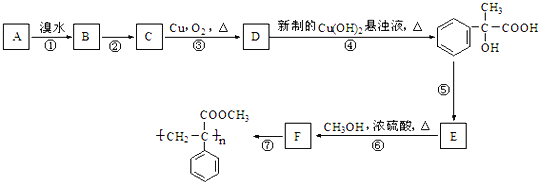
请回答下列问题:
(1)反应①到⑥中消去反应是:_______________。
(2)反应②的条件为:_______________。
(3)A结构简式:_______________。
(4)反应③化学方程式:______________________________________________________。
(5)在E的粗产物中,经检测含有高分子聚合物杂质。写出该高聚物杂质的结构简式:____________。
(6)写出满足下列条件的E的一种同分异构体的结构简式:_______________。
Ⅰ.苯环上的一元取代物只有两种结构;
Ⅱ.能发生银镜反应
Ⅲ.与氯化铁溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com