
����Ŀ�������������������Ҫ��Ӧ�ǣ�4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)��
4NO(g) + 6H2O(g)��
��1�������¶ȣ���Ӧ��ƽ�ⳣ��Kֵ��С����÷�Ӧ���ʱ���H_____0������������������������������
��2��������˵��������Ӧ�Ѵﵽƽ��״̬__________������ţ�
A.NH3��Ũ�Ȳ���ʱ��仯
B.v��(O2)= v��(NO)
C.��ϵ�ķ����������ٱ仯
D.��λʱ��������4molNH3��ͬʱ����6molH2O
��3���������������䣬���й�ϵͼ�������______��ѡ����ţ���
A.  B.
B.  C.
C.  D.
D. 
��4�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±���
ʱ��/Ũ��/(mol��L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
��ʼ | 4.0 | 5.5 | 0 | 0 |
�� 2 min | 3.2 | 0.8 | 1.2 | |
�� 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
�� 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
���ϱ��пհ״�Ӧ�������Ϊ______��
�ڷ�Ӧ�ڵ� 2 min ���� 4 min ʱ����Ӧ����v(O2)��___________��
�۷�Ӧ�ڵ� 2 min ʱ�ı����������ı����������______;�������£���Ӧ��ƽ�ⳣ��K��_______��ֻд�����������굥λ����
���𰸡��� AC C 4.5 ![]() �����¶�(��ʹ�ô���) 3
�����¶�(��ʹ�ô���) 3
��������
(1)�¶����ߣ�Kֵ��С��˵��ƽ�����ƣ�
(2)����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯���ݴ˽�𣬽���ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
(3)���ݷ�Ӧ���ص�����¶ȡ�ѹǿ��������ƽ���Ӱ�죻
(4)�ٸ���0-2minʱ���ڰ���Ũ�ȵı仯������������Ũ�ȵı仯����
�ڸ���![]() ���㷴Ӧ���ʣ�
���㷴Ӧ���ʣ�
���ɱ������ݿ�֪��2min�Ժ�Ӧ���ʼӿ죬�ݴ˷�����
(1)�����¶ȣ���Ӧ��ƽ�ⳣ��Kֵ��С��˵��ƽ�����ƣ������¶�ƽ�����ƣ�������ӦΪ���ȷ�Ӧ������H��0��
(2)A. ����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬����NH3��Ũ�Ȳ���ʱ��仯˵����Ӧ�ﵽƽ�⣬��A��ȷ��
B.ͬһ��Ӧ�з�Ӧ����֮�ȵ��ڼ�����֮�ȣ����ﵽƽ��ʱv��(O2)= v��(O2) ��v��(NO)=v��(NO)��4v��(O2) =5v��(NO)������v��(O2)= v��(NO)����˵����Ӧ�ﵽƽ��״̬����B����
C.ƽ�������ƶ�ʱ��ϵ������ķ�����������������ϵ�ķ����������ٱ仯ʱ˵����Ӧ�ﵽƽ�⣬��C��ȷ��
D.��λʱ��������4molNH3��ͬʱ����6molH2O����6v��(NH3) =4v��(H2O)�����۷�Ӧ�Ƿ�ﵽƽ�ⶼ���ڴ˹�ϵ����D����
�ʴ�Ϊ��AC��
(3)��֪4NH3(g)+5O2(g)4NO(g)+6H2O(g)����H��0�����÷�ӦΪ�������ķ��ȷ�Ӧ��
A�������¶�ƽ�����ƣ������¶�Խ��NH3�ĺ���Խ�࣬��ͼ�����������ȷ��
B������ѹǿƽ�����ƣ�����ѹǿԽ��NOԽС����ͼ�����������ȷ��
C�������¶�ƽ�����ƣ������¶�Խ��H2O�ĺ���ԽС����ͼ��������ʴ���
D���Ӵ������ı�ƽ�⣬����O2�ĺ������䣬��Ӧ����������ƽ���ʱ���С����ͼ�����������ȷ��
�ʴ�Ϊ��C��
(4)�ٵ� 0min ���� 2min ʱ��c(NH3)=4.0-3.2=0.8molL-1�����ԡ�c(O2)=![]() ��0.8molL-1=1.0 molL-1�����Ե� 2min ʱc(O2)=5.5-1.0=4.5 molL-1��
��0.8molL-1=1.0 molL-1�����Ե� 2min ʱc(O2)=5.5-1.0=4.5 molL-1��
��![]() =
=![]() ��
��
���ɱ������ݿ�֪��0��2minʱ������NH3Ϊ0.8 molL-1���� 2min ���� 4min ʱ����NH3Ϊ1.2molL-1��˵���� 2min �Ժ�Ӧ���ʼӿ죬���Ըı������Ϊ�����¶�(��ʹ�ô���)��ƽ��ʱc(NH3)=2.0 molL-1��c(O2)=3.0molL-1��c(NO)=2.0molL-1��c(H2O)=3.0molL-1����K=![]() ��
��


 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������䡶������ּ��������ˡ���ǿˮ���� �����̷�(FeSO47H2O)������������ȥ��Լ�����֮һ������ζͬ��ϸ������������������ �������ȡ���䶨����̳��ҩ��Ϊˮ��������ˮ�����Գ�ˮ��Ω�ƽ�ˮ�У�����������ǿˮ�ù������������������йؽ��ʹ������
A.��������ȥ��Լ�����֮һ��������FeSO44H2O
B.�÷������조ǿˮ��Ϊ����
C.��Ω�ƽ�ˮ�У���������ԭ���Ǽ��� NaCl��Һ����������ǿ
D.��ǿˮ�ù���������ԭ���ǡ�ǿˮ���ù��Ժ���������������Һ���������Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ������Ҫ�Ļ�����ϵ��̼�����λ�����ϵ![]() ��Ϊ��
��Ϊ��![]() �������ж���ȷ���ǣ� ��
�������ж���ȷ���ǣ� ��
A.������ѪҺ��![]()
B.����ѪҺ��̼�����λ�����ϵ��Ҫ��ά��ѪҺ��![]() ��
��![]() ��ƽ��
��ƽ��
C.ѪҺ��![]() �ĵ��뷽��ʽΪ��
�ĵ��뷽��ʽΪ��![]()
D.������ѪҺ�д��ڣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2O2�ֽ������ܶ�������Ӱ�죬ijС��Դ˽���̽�����õ����½��������˵������ȷ����
��� | H2O2�����ml�� | FeCl3�����ml�� | �����ҺpH | ��H2O2pH | �ֽ���ȫʱ�䣨s�� |
1 | 20 | 10 | 1.00 | 2.92 | �������ֽ� |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
��1 ��200C) | |||||
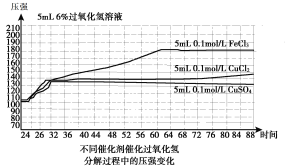
ͼ1��200C��
A.��1����������������ͬʱ������������H2O2�ֽ����ʿ�������������
B.ͼ1����������������ͬʱ��ͭ�ζ�H2O2�ֽ�Ĵ�Ч����������
C.ͼ1����������������ͬʱ��CuCl2��H2O2�ֽ�Ĵ�Ч������CuSO4
D.����ʵ���������������Һ����Զ�H2O2�ֽ����ʶ���Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����AgCl����ˮ�γɱ�����Һ
��1��д�������ܽ�ƽ�ⷽ��ʽ___________________________________�� д��AgCl��Ksp����ʽ________________________________________
��2������ñ�����Һ�м���NaCl���壬��C(Ag+)_____(��������������������
�����������£���Ũ�Ⱦ�Ϊ0.1molL-1������4����Һ��
��NaCN��Һ��NaOH��Һ��CH3COONa��Һ��NaHCO3��Һ
HCN | H2CO3 | CH3COOH |
Ka=4.9��10-10 | Ka1=4��10-7 Ka2=5.6��10-11 | Ka=1.7��10-5 |
��1����4����ҺpH��С����______(�����)��
��2�����и�����Ũ���ɴ�С��˳����_______________________��
��3���ܵ�ˮ�ⷽ��ʽΪ______________________________________������ˮ��ƽ�ⳣ����������Ϊ______��
��4��25��ʱ�����HCN��NaCN�Ļ����Һ��pH=11����c(HCN)��c(CN-)֮��Ϊ____________����NaCN��Һ��ͨ������CO2��������Ӧ�����ӷ���ʽΪ_____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״������ǿ��������õ�һ������Դ����֪��
��2H2(g)+O2(g)=2H2O(l) ��H1=-571.8kJ�� mol-1
��CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ��H=-192.9 kJ�� mol-1
O2(g)=CO2(g)+2H2(g) ��H=-192.9 kJ�� mol-1
��1���״�������ȫȼ�յ��Ȼ�ѧ����ʽΪ_____________��
��2����Ӧ���е������仯����ͼ��ʾ������H2=______����E1��E2��ʾ����

��3��H2(g)��ȼ����Ϊ__________ kJ�� mol-1��
��4���������H2(g)��Ϊ��Դ�ȼ״�������Ϊ��Դ���ŵ㣺__________________��д��һ�㣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ���ǣ� ��
A.�ù�����ˮ���չ�ҵβ���е�SO2��2NH3��H2O��SO2=2NH4+��SO32-��H2O
B.Ca(HCO3)2��Һ������NaOH��Һ��Ӧ��Ca2����2HCO3-��2OH��=CaCO3����CO32-��2H2O
C.������������������ϡ��� Fe3O4��8H��=Fe2����2Fe3����4H2O
D.������Һ�е���Ba(OH)2��ҺʹSO42-ǡ����ȫ������2Ba2����3OH����Al3����2SO42-=2BaSO4����Al(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�е����ӹ�ϵ��ȷ���ǣ� ��
A.��ͬ�¶��£�0.2 mol��L-1�Ĵ�����Һ��0.l mol��L-1�Ĵ�����Һ��c(H+)֮�ȴ���2 : 1
B.pH=3�Ĵ����pH=3��FeCl3��Һ�У���ˮ�������c(H+)���
C.0.l mol�qL-1NaHSO4��Һ�У�c(H+)=c(SO![]() ) +c(OH-)
) +c(OH-)
D.pH=4��Ũ�Ⱦ�Ϊ0.l mol��L-1��CH3COOH��CH3COONa �����Һ�У�c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��

(1)��A�ǵ���ɫ���壬C��D�������C������������Ҫ���ʣ���CҲ����㷺����;��д�����е�������;��_____________________________��
(2)��B����̬�⻯�C��D���������һ���ɹ⻯ѧ������Ⱦ��B��C��һ�������·�Ӧ���ɵ�A�Ǵ�������Ҫ�ɷ֣�д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________��
(3)��D���ʾ������ԣ��ڡ��۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧʱͨ�������һ����������ЧӦ����Ҫ���塣�жϵ���A��Ԫ�������ڱ��е�λ�ã�___________________________��
(4)��A��̫���ܵ���õĹ�����ϡ�C��DΪ���Σ����������г��ơ������Ԫ��Ϊͬһ���壬����Һ���Լ��ԡ�д���ڷ�Ӧ�Ļ�ѧ����ʽ��_______________________________��
D�Ļ�ѧʽ��________��
(5)��A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڡ��ݷ�Ӧ���õ�ͬһ�ַǽ������ʡ�C����Һ����ʴ��ӡˢͭ��·�壬д���÷�Ӧ�����ӷ���ʽ��_________________________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com