
【题目】人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系![]() 即为:
即为:![]() 。下列判断正确的是( )
。下列判断正确的是( )
A.正常人血液内![]()
B.人体血液里碳酸氢盐缓冲体系主要是维持血液中![]() 和
和![]() 的平衡
的平衡
C.血液中![]() 的电离方程式为:
的电离方程式为:![]()
D.正常人血液中存在:![]()
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1molL-1CH3COOH溶液中加入少量水,溶液中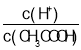 减小
减小
B.向0.1molL-1的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
C.向一定浓度的醋酸溶液中加水稀释,则溶液中 增大
增大
D.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,![]() 不断增大
不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,下列叙述中不正确的是( )
A. 0.1 mol/L 的 CH3COOH 溶液中加水稀释,溶液中所有离子浓度均减小
B. 醋酸溶液中离子浓度的关系满足:c(H+) = c(CH3COO-) + c(OH- )
C. CH3COOH 溶液中加入少量 CH3COONa(s),平衡逆向移动
D. 常温下,pH = 2 的 CH3COOH 溶液与 pH = 12 的 NaOH 溶液等体积混合后,溶液的 pH < 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。
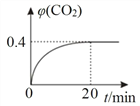
②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )

A. HA是一种强酸
B. x点,c(A-)=c(B-)
C. HB是一种弱酸
D. 原溶液中HA的物质的量浓度为HB的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)。
4NO(g) + 6H2O(g)。
(1)升高温度,反应的平衡常数K值减小,则该反应的焓变△H_____0(填“>”、“<”或“=”)。
(2)下列能说明上述反应已达到平衡状态__________(填序号)
A.NH3的浓度不随时间变化
B.v正(O2)= v逆(NO)
C.体系的分子总数不再变化
D.单位时间内消耗4molNH3的同时生成6molH2O
(3)若其他条件不变,下列关系图错误的是______(选填序号)。
A.  B.
B.  C.
C.  D.
D. 
(4)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2 min | 3.2 | 0.8 | 1.2 | |
第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
①上表中空白处应填的数字为______。
②反应在第 2 min 到第 4 min 时,反应速率v(O2)=___________。
③反应在第 2 min 时改变了条件,改变的条件可能______;该条件下,反应的平衡常数K=_______(只写计算结果,不标单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
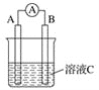
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com