
【题目】下列措施能够使水的离子积常数增大的是( )
A.温度不变,加入一定量的硫酸B.温度不变,加入一定量的NaOH
C.升高温度D.降低温度
【答案】C
【解析】
A.温度不变向水中加入H2SO4溶液,溶液中c(H+)增大,c(OH-)减小,水的离子积常数KW= c(H+)![]() c(OH-)不变,故A不符合题意;
c(OH-)不变,故A不符合题意;
B.温度不变向水中加入NaOH,溶液中c(OH-)增大,c(H+)减小,水的离子积常数KW= c(H+)![]() c(OH-)不变,故B不符合题意;
c(OH-)不变,故B不符合题意;
C.水的电离是吸热过程,升高温度,平衡向电离方向移动,c(OH-)增大,c(H+)增大,KW= c(H+)![]() c(OH-)增大,故C符合题意;
c(OH-)增大,故C符合题意;
D.水的电离是吸热过程,降低温度,平衡逆向移动,c(OH-)减小,c(H+)减小,KW= c(H+) ![]() c(OH-)减小,故D不符合题意;
c(OH-)减小,故D不符合题意;
所以答案:C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol·L-1
D. 反应开始时,乙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系![]() 即为:
即为:![]() 。下列判断正确的是( )
。下列判断正确的是( )
A.正常人血液内![]()
B.人体血液里碳酸氢盐缓冲体系主要是维持血液中![]() 和
和![]() 的平衡
的平衡
C.血液中![]() 的电离方程式为:
的电离方程式为:![]()
D.正常人血液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN是一种剧毒性的酸,常温下,0.10molL-1HCN溶液的pH = 3,下列说法正确的是( )
A.HCN是一种强酸
B.相同浓度的NaCl溶液与NaCN溶液,前者的pH更大
C.在NaCN溶液中存在:c(Na+) = c(HCN) + c(CN-)
D.中和相同体积与浓度的HCl溶液与HCN溶液,所消耗的NaOH溶液的体积不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2分解速率受多种因素影响,某小组对此进行探究,得到如下结果。下列说法不正确的是
序号 | H2O2体积(ml) | FeCl3体积(ml) | 混合溶液pH | 纯H2O2pH | 分解完全时间(s) |
1 | 20 | 10 | 1.00 | 2.92 | 几乎不分解 |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
表1 (200C) | |||||
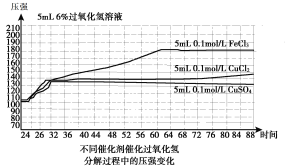
图1(200C)
A.表1表明,其他条件相同时,碱性条件下H2O2分解速率快于酸性条件下
B.图1表明,其他条件相同时,铜盐对H2O2分解的催化效果好于铁盐
C.图1表明,其他条件相同时,CuCl2对H2O2分解的催化效果好于CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解速率都有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下, 将稀 HCl溶液滴加到等浓度的弱碱 AOH溶液中, 测得混合液的 pH和lg[C(AOH)/C(A+)] 的关系如图所示, 其中 a点表示未加盐酸时的数据, e点表示 HCl和 AOH恰好完全反应时的数据。下列说法错误的是

A. 常温下, A+的水解平衡常数为 1.0×10-10
B. 点e溶液中水电离出的H+浓度为 10-6.23mol/L
C. 点c 溶液中的 n(A+)+n(AOH)等于点 e溶液中的 n(Cl-)
D. 点d溶液中: c(Cl-)> c(AOH)>c(A+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com