
【题目】关于滴定实验的下列说法正确的是
A.在酸碱中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化
B.用NaOH标准溶液滴定未知浓度的盐酸,到达终点时发现滴定管尖嘴部分有悬滴,会使测定结果偏小
C.用![]() 标准溶液滴定草酸时,
标准溶液滴定草酸时,![]() 标准溶液盛装在碱式滴定管中
标准溶液盛装在碱式滴定管中
D.所有的滴定实验都需加入指示剂
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯![]() 是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用.以下是某校化学研究小组设计实验室制取
是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用.以下是某校化学研究小组设计实验室制取![]() 的工艺流程图.下列有关说法正确的是
的工艺流程图.下列有关说法正确的是
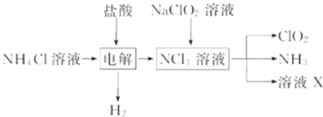
A.电解时发生反应的化学方程式为:2HCl![]() Cl2
Cl2![]() +H2
+H2![]()
B.由NaClO2溶液制取0.6molClO2时,至少消耗0.1molNCl3
C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3
D.溶液X的成分为NaClO2和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
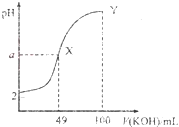
A.当加入![]() mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
B.HA为弱酸,常温下,Ka的数量级为![]()
C.Y点对应的溶液中:![]()
D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1molL-1和0.01molL-1的醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液,溶液变成红色 | 原Fe(NO3)2中一定含有Fe3+ |
C | 向AgCl悬浊液中滴入KI溶液,悬浊液变为黄色 | Ksp(AgCl)>Ksp(AgI) |
D | 常温下,分别测量浓度均为0.1molL-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性:HClO>H2S |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 下,弱电解质的电离平衡常数
下,弱电解质的电离平衡常数![]() ,下列说法正确的是
,下列说法正确的是
A.用![]() 的盐酸滴定
的盐酸滴定![]() 的氨水时,可用酚酞作指示剂
的氨水时,可用酚酞作指示剂
B.![]() 的醋酸与
的醋酸与![]() 的氢氧化钠溶液等体积混合,所得溶液中:
的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.pH相同的![]() 、
、![]() 的两种溶液的
的两种溶液的![]() :
:![]()
D.![]() 的醋酸与
的醋酸与![]() 的氨水等体积混合,所得溶液中由水电离出的
的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验现象的说法不正确的是

A. 氨气是无色有刺激性气味的气体,密度比空气小
B. 实验1,由喷泉现象可知氨气极易溶于水且溶解速率快
C. 实验1,烧瓶溶液中的含氮微粒有:NH3、NH3·H2O和NH4+
D. 实验2,加热过程中温度和c(NH3·H2O)对NH3·H2O电离平衡移动方向的影响一致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是

A. a=20,b=40,且溶液呈中性处于A、B两点之间
B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH![]() )
)
C. 已知lg3≈0.5,则C点的pH≈5
D. A、B、C三点中,B点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )

A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com