
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )

A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
【答案】B
【解析】
A.根据图分析可知,b点导电能力最强,故b点溶液中的离子浓度最大,故A错误;
B.根据起点PH=3,Ka=c(H+)c(R-)/c(HR)=(10-3)2/0.1=10-5,代入Kh=Kw/Ka=10-14/10-5=10 -9,故B正确;
C. a点是酸过量,抑制水的电离,b点恰好中和,水解促进水的电离,故C错误;
D. d点是NH4R和NH3H2O的混合物,它们物质的量浓度相等,故物料守恒:2c(R-)+2c(HR)=c(NH3H2O)+c(NH4+),电荷守恒:c(NH4+)+c(H+)= c(R-)+c(OH-),两式相加可得,2c(HR)+ c(H+)+ c(R-)= c(NH3H2O)+ c(OH-),故D错误;
故选B。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】电影《流浪地球》讲述了太阳即将爆发氦闪”(3He![]() C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
A. 核素![]() 的中子数比电子数多2
的中子数比电子数多2
B. 上述元素除氮之外仅能形成6种单质和4种氧化物
C. 碳、氢、氧元素组成的糖类物质均可发生水解
D. 上述元素组成的草酸亚铁(FeC2O4)中碳元素的化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
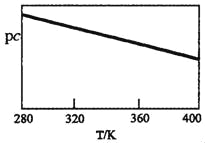
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
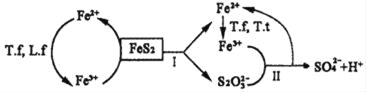
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )

A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的CuSO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图完成回收硫酸亚铁和铜的简单实验方案,回答下列问题:(图中所加试剂均为过量,流程图中无需填写)

(1)操作f的名称为____________,物质c的成分_________________
(2)试剂a的化学式为_____,加入该试剂所发生的化学方程式为______________。
(3)请写出c→h+k的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2p轨道上最多只能排布6个电子,其依据的规律是__________________。
(2)氧元素基态原子核外未成对电子数为________个,第三周期中有两个成单电子的元素符号________(填一种即可),M层上有2对成对电子的原子最外层共有________种不同运动状态的电子。
(3)1~36号元素原子中未成对电子数为2的元素符号及价电子排布式________________。
(4)X元素的价电子排布式是4s24p5,X元素的符号是________。
(5)某元素的原子序数为33,该元素原子的价电子排布式为________,该元素原子核外有________个电子层,________个能级,________个原子轨道。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com