
°æƒø°ø∂˛—ıªØ¬»![]() «“ª÷÷π„∆◊°¢∏þ–ßµƒœ˚∂溡£¨“◊»Ð”⁄ÀÆ£¨”»∆‰‘⁄ÀÆ¥¶¿Ìµ»∑Ω√Ê”–π„∑∫”¶”√£Æ“‘œ¬ «ƒ≥–£ªØ—ß—–æø–°◊ȅ˺∆ µ—È “÷∆»°
«“ª÷÷π„∆◊°¢∏þ–ßµƒœ˚∂溡£¨“◊»Ð”⁄ÀÆ£¨”»∆‰‘⁄ÀÆ¥¶¿Ìµ»∑Ω√Ê”–π„∑∫”¶”√£Æ“‘œ¬ «ƒ≥–£ªØ—ß—–æø–°◊ȅ˺∆ µ—È “÷∆»°![]() µƒπ§“’¡˜≥ÃÕº£Æœ¬¡–”–πÿÀµ∑®’˝»∑µƒ «
µƒπ§“’¡˜≥ÃÕº£Æœ¬¡–”–πÿÀµ∑®’˝»∑µƒ «
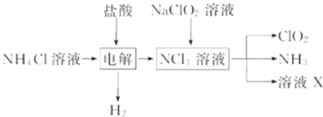
A.µÁΩ‚ ±∑¢…˙∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™£∫2HCl![]() Cl2
Cl2![]() +H2
+H2![]()
B.”…NaClO2»Ð“∫÷∆»°0.6molClO2 ±£¨÷¡…Ÿœ˚∫ƒ0.1molNCl3
C.Ω´≤˙…˙µƒªÏ∫œ∆¯ÃÂÕ®π˝ ¢”–ºÓ ت“µƒ∏…‘Ô∆˜“‘≥˝»•ClO2÷–µƒNH3
D.»Ð“∫Xµƒ≥…∑÷Œ™NaClO2∫ÕNaOH
°æ¥∞∏°øB
°æΩ‚Œˆ°ø
A.∏˘æð¡˜≥ÃÕº÷™,µÁΩ‚¬»ªØÔß∫Õ—ŒÀ·ªÏ∫œ»Ð“∫…˙≥…«‚∆¯∫ÕNCl3£¨∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™£∫![]()
![]()
![]() £¨π A¥ÌŒÛ£ª
£¨π A¥ÌŒÛ£ª
B. NCl3”ÎNaClO2∞¥ŒÔ÷ µƒ¡ø÷Ʊ»Œ™1£∫6«°∫√∑¥”¶…˙≥…ClO2°¢¬»ªØƒ∆°¢«‚—ıªØƒ∆∫Õ∞±∆¯£¨∑¥”¶÷–Cl‘™ÀÿµƒªØ∫œº€…˝∏þ±ª—ıªØ£¨‘ÚN‘™ÀÿªØ∫œº€ΩµµÕ±ªªπ‘≠£¨ªØ—ß∑Ω≥Ã ΩŒ™£∫![]() £¨”…∑Ω≥à Ωø…÷™NaClO2»Ð“∫÷∆»° 0.6molClO2 ±£¨÷¡…Ÿœ˚∫ƒ0.1molNCl3£¨π B’˝»∑£ª
£¨”…∑Ω≥à Ωø…÷™NaClO2»Ð“∫÷∆»° 0.6molClO2 ±£¨÷¡…Ÿœ˚∫ƒ0.1molNCl3£¨π B’˝»∑£ª
C.∞±∆¯Œ™ºÓ–‘∆¯Ã£¨ºÓ ت“≤ªƒÐŒ¸ ’∞±∆¯£¨”¶∏√”√≈®¡ÚÀ·Œ¸ ’∞±∆¯£¨π C¥ÌŒÛ£ª
D.Ω·∫œµÁ◊” ÿ∫„º∆À„∑÷Œˆø…÷™£¨NCl3”ÎNaClO2∞¥ŒÔ÷ µƒ¡ø÷Ʊ»Œ™1£∫6«°∫√∑¥”¶…˙≥…ClO2°¢∞±∆¯°¢¬»ªØƒ∆∫ÕNaOH£¨π D¥ÌŒÛ£ª
π —°B°£


 ‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¡ÚÀ·–øø…”√”⁄÷∆‘Ï–ø±µ∞◊°¢”°»æ√Ω»æº¡µ»°£”√–ø∞◊øÛ(÷˜“™≥…∑÷Œ™ZnO£¨ªπ∫¨”–Fe2O3°¢CuO°¢SiO2µ»‘”≥…) ÷∆±∏ZnSO4 °§7H2Oµƒ¡˜≥ûÁœ¬°£
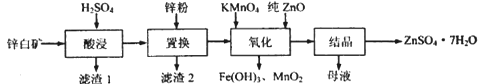
œýπÿΩ Ù¿Î¡À…˙≥…«‚—ıªØŒÔ≥¡µÌµƒpH (ø™ º≥¡µÌµƒpH∞¥Ω Ù¿Î◊”≈®∂»Œ™1.0mol°§L-1º∆À„£©»Áœ¬±Ì£∫
Ω Ù¿Î◊” | ø™ º≥¡µÌµƒpH | ≥¡µÌÕÍ»´µƒpH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)°∞¬À‘¸1°±µƒ÷˜“™≥…∑÷Œ™_________(ÃÓªØ—ß Ω£©°£°∞À·Ω˛°±π˝≥Ã÷–£¨Ã·∏þ–ø‘™ÀÿΩ˛≥ˆ¬ µƒ¥Î ©”–£∫ µ±Ã·∏þÀ·µƒ≈®∂»°¢______________(ÃÓ“ª÷÷)°£
(2)°∞÷√ªª°±π˝≥Ã÷–£¨º”»Î ¡øµƒ–ø∑€£¨≥˝”λГ∫÷–µƒFe3+£¨H+∑¥”¶Õ‚£¨¡Ì“ª÷˜“™∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™__________________________°£
(3)°∞—ıªØ°±“ª≤Ω÷–£¨∑¢…˙∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™_______________________°£»Ð“∫pHøÿ÷∆‘⁄[3.2£¨6.4)÷ƺ‰µƒƒøµƒ «________________°£
(4)°∞ƒ∏“∫°±÷–∫¨”–µƒ—Œ¿ýŒÔ÷ ”–_________ (ÃÓªØ—ß Ω£©°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øH°¢Al°¢O°¢N°¢S°¢Fe «≥£º˚µƒ¡˘÷÷‘™Àÿ°£
£®1£©SŒª”⁄‘™Àÿ÷Ð∆⁄±Ì______÷Ð∆⁄µ⁄______◊£¨Feµƒª˘Ã¨‘≠◊”∫ÀÕ‚º€µÁ◊”≈≈≤º ΩŒ™______£ªOµƒª˘Ã¨‘≠◊”∫ÀÕ‚”–______÷÷‘À∂Ø◊¥Ã¨≤ªÕ¨µƒµÁ◊”°£
£®2£©”√°∞£æ°±°∞£º°±ªÚ°∞=°±ÃÓø’
µ⁄“ªµÁ¿ÎƒÐ | —ıªØ–‘ | ∑–µ„ | ∑«Ω Ù–‘ |
N______S | Fe3+______ Al3+ | NH3______H2O | 16O______18O |
£®3£©“—÷™£∫œ¬¡–¡Ω∏ˆ»»ªØ—ß∑Ω≥Ã Ω£∫
4Fe£®s£©+302£®g£©=2Fe2O3£®s£©°˜H=©Åa kJ/mol
4Al£®s£©+3O2£®g£©=2Al2O3£®s£©°˜H=©Åb kJ/mol
‘ÚAl£®s£©µƒµ•÷ ∫ÕFe2O3£®s£©∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã Ω «______°£
£®4£©FeSO4»Ð“∫ø…”ÎœıÀ·∑¢…˙∑¥”¶£¨–¥≥ˆ¥À∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω£¨≤¢±Í≥ˆµÁ◊”◊™“∆µƒ∑ΩœÚ∫Õ ˝ƒø____________________________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¢Òƒ≥“ª∑¥”¶ÃÂœµ”–∑¥”¶ŒÔ∫Õ…˙≥…ŒÔπ≤ŒÂ÷÷ŒÔ÷ £∫![]() °¢
°¢![]() °¢
°¢![]() °¢
°¢![]() °¢
°¢![]() “—÷™∏√∑¥”¶÷–
“—÷™∏√∑¥”¶÷–![]() ÷ª∑¢…˙»Áœ¬π˝≥ã∫
÷ª∑¢…˙»Áœ¬π˝≥ã∫![]()
(1)∏√∑¥”¶÷–µƒªπ‘≠º¡ «_____________°£
(2)–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£¨≤¢”√µ•œþ«≈∑®±Í≥ˆµÁ◊”◊™“∆µƒ∑ΩœÚ∫Õ ˝ƒø£∫_____________
(3)…œ ˆ∑¥”¶÷–√ø…˙≥…![]() …˝—ı∆¯
…˝—ı∆¯![]() ±Í◊º◊¥øˆ
±Í◊º◊¥øˆ![]() £¨◊™“∆µÁ◊” ˝ «_________________°£
£¨◊™“∆µÁ◊” ˝ «_________________°£
¢ÚÀƒ—ıªØ»˝Ã˙![]() ¥≈–‘ƒ…√◊ø≈¡£Œ»∂®°¢»ð“◊…˙≤˙«“”√Õæπ„∑∫£¨ «¡Ÿ¥≤’Ô∂œ°¢…˙ŒÔºº ı∫Õª∑æ≥ªØ—ß¡Ï”Ú∂ý÷÷«±‘⁄”¶”√µƒ”–¡¶π§æþ°£ÀÆ»»∑®÷∆±∏
¥≈–‘ƒ…√◊ø≈¡£Œ»∂®°¢»ð“◊…˙≤˙«“”√Õæπ„∑∫£¨ «¡Ÿ¥≤’Ô∂œ°¢…˙ŒÔºº ı∫Õª∑æ≥ªØ—ß¡Ï”Ú∂ý÷÷«±‘⁄”¶”√µƒ”–¡¶π§æþ°£ÀÆ»»∑®÷∆±∏![]() ƒ…√◊ø≈¡£µƒ∑¥”¶ «
ƒ…√◊ø≈¡£µƒ∑¥”¶ «![]() x
x![]() °£«Îªÿ¥œ¬¡–Œ °£
°£«Îªÿ¥œ¬¡–Œ °£
(4)ÀÆ»»∑®÷∆±∏![]() ƒ…√◊ø≈¡£µƒ∑¥”¶÷–£¨ªπ‘≠º¡ «____________°£
ƒ…√◊ø≈¡£µƒ∑¥”¶÷–£¨ªπ‘≠º¡ «____________°£
(5)∑¥”¶µƒªØ—ß∑Ω≥à Ω÷–x![]() ________°£
________°£
(6)√ø…˙≥…![]() £¨∑¥”¶◊™“∆µƒµÁ◊”Œ™________mol£¨±ª
£¨∑¥”¶◊™“∆µƒµÁ◊”Œ™________mol£¨±ª![]() ªπ‘≠µƒ
ªπ‘≠µƒ![]() µƒŒÔ÷ µƒ¡øŒ™________mol°£
µƒŒÔ÷ µƒ¡øŒ™________mol°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“ª÷÷÷∆±∏∏þ–ß∆Ø∞◊º¡NaC1O2µƒ µ—È¡˜≥ûÁÕºÀ˘ 棨∑¥”¶IµƒªØ—ß∑Ω≥Ã ΩŒ™£∫ 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,œ¬¡–Àµ∑®’˝»∑µƒ «

A.NaClO2µƒ∆Ø∞◊‘≠¿Ì”ÎSO2œýÕ¨
B.∑¥”¶I÷–—ıªØ≤˙ŒÔ∫Õªπ‘≠≤˙ŒÔŒÔ÷ µƒ¡ø±»Œ™4:3
C.∑¥”¶II÷–H2O2◊ˆ—ıªØº¡
D. µ—È “Ω¯––’Ù∑¢≤Ÿ◊˜Õ®≥£‘⁄€·€ˆ÷–Ω¯––
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø”√µÁΩ‚∑®¥¶¿Ì∫¨![]() µƒ∑œÀÆ£¨ÃΩæø≤ªÕ¨“ÚÀÿ∂‘∫¨
µƒ∑œÀÆ£¨ÃΩæø≤ªÕ¨“ÚÀÿ∂‘∫¨![]() ∑œÀÆ¥¶¿Ìµƒ”∞œÏ£¨Ω·π˚»Á±ÌÀ˘ æ
∑œÀÆ¥¶¿Ìµƒ”∞œÏ£¨Ω·π˚»Á±ÌÀ˘ æ![]() µƒ∆ º≈®∂»°¢Ãª˝°¢µÁ—π°¢µÁΩ‚ ±º‰æ˘œýÕ¨
µƒ∆ º≈®∂»°¢Ãª˝°¢µÁ—π°¢µÁΩ‚ ±º‰æ˘œýÕ¨![]() °£œ¬¡–Àµ∑®¥ÌŒÛµƒ «
°£œ¬¡–Àµ∑®¥ÌŒÛµƒ « ![]()
![]()
µ—È |
|
|
|
|
|
«∑Òº”»Î | ∑Ò | ∑Ò | º”»Î30g | ∑Ò | |
«∑Òº”»ÎH2SO4 | ∑Ò | º”»Î1mL | º”»Î1mL | º”»Î1mL | |
“ıº´≤ƒ¡œ | ؃´ | ؃´ | ؃´ | ؃´ | |
—Ùº´≤ƒ¡œ | ؃´ | ؃´ | ؃´ | Ã˙ | |
| 0.092% | 12.7% | 20.8% | 57.3% | µ—È |
A. µ—È![]() ”Î µ—È
”Î µ—È![]() ∂‘±»£¨∆‰À˚Ãıº˛≤ª±‰£¨‘ˆº”
∂‘±»£¨∆‰À˚Ãıº˛≤ª±‰£¨‘ˆº”![]() ”–¿˚”⁄
”–¿˚”⁄![]() µƒ»•≥˝
µƒ»•≥˝
B. µ—È![]() ”Î µ—È
”Î µ—È![]() ∂‘±»£¨∆‰À˚Ãıº˛≤ª±‰£¨‘ˆº”
∂‘±»£¨∆‰À˚Ãıº˛≤ª±‰£¨‘ˆº”![]() ”–¿˚”⁄
”–¿˚”⁄![]() µƒ»•≥˝
µƒ»•≥˝
C. µ—È![]() ÷–
÷–![]() —≠ª∑¿˚”√÷∏þ¡À
—≠ª∑¿˚”√÷∏þ¡À![]() µƒ»•≥˝¬
µƒ»•≥˝¬
D.»Ù µ—È![]() ÷–»•≥˝
÷–»•≥˝![]() £¨µÁ¬∑÷–π≤◊™“∆0.06molµÁ◊”
£¨µÁ¬∑÷–π≤◊™“∆0.06molµÁ◊”
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øŒ™”––ßøÿ÷∆ŒÌˆ≤£¨∏˜µÿª˝º´≤…»°¥Î ©∏ƒ…∆¥Û∆¯÷ ¡ø£¨—–æø≤¢”––ßøÿ÷∆ø’∆¯÷–µƒµ™—ıªØŒÔ°¢Ãº—ıªØŒÔ∫Õ¡Ú—ıªØŒÔœ‘µ√”»Œ™÷ÿ“™°£
(1)∆˚≥µƒ⁄»ºª˙π§◊˜ ±ª·“˝∆N2∫ÕO2µƒ∑¥”¶£∫N2+O2![]() 2NO£¨ «µº÷¬∆˚≥µŒ≤∆¯÷–∫¨”–NOµƒ‘≠“Ú÷Æ“ª°£
2NO£¨ «µº÷¬∆˚≥µŒ≤∆¯÷–∫¨”–NOµƒ‘≠“Ú÷Æ“ª°£
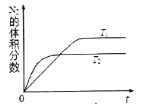
¢Ÿ‘⁄T1°¢T2Œ¬∂»œ¬£¨“ª∂®¡øµƒNO∑¢…˙∑÷Ω‚∑¥”¶ ±N2µƒÃª˝∑÷ ˝ÀÊ ±º‰±‰ªØ»ÁÕºÀ˘ 棨∏˘æðÕºœÒ≈–∂œ∑¥”¶N2(g)+O2(g) ![]() 2NO(g)µƒ°˜H______0(ÃÓ°∞>°±ªÚ°∞<°±)°£
2NO(g)µƒ°˜H______0(ÃÓ°∞>°±ªÚ°∞<°±)°£
¢⁄‘⁄T3Œ¬∂»œ¬£¨œÚ2L√б’»ð∆˜÷–≥‰»Î10molN2”Î5mo1O2£¨50√Î∫Û¥ÔµΩ∆Ω∫‚£¨≤‚µ√NOµƒŒÔ÷ µƒ¡øŒ™2mol£¨‘Ú∏√∑¥”¶µƒÀŸ¬ ¶‘(N2)=_______________°£∏√Œ¬∂»œ¬£¨»Ù‘ˆ¥Û—π«ø¥À∑¥”¶µƒ∆Ω∫‚≥£ ˝Ω´______£®ÃÓ°∞‘ˆ¥Û°±°∞ºı–°°±°∞≤ª±‰°±°∞ŒÞ∑®»∑∂®°±£©»Ùø™ º ±œÚ…œ ˆ»ð∆˜÷–≥‰»ÎN2”ÎO2æ˘Œ™1 mol£¨‘Ú¥ÔµΩ∆Ω∫‚∫ÛN2µƒ◊™ªØ¬ Œ™____________°£
(2)¿˚”√œ¬ÕºÀ˘ æ◊∞÷√(µÁº´æ˘Œ™∂Ë–‘µÁº´)ø…Œ¸ ’SO2£¨”√“ıº´≈≈≥ˆµƒ»Ð“∫ø…Œ¸ ’NO2°£
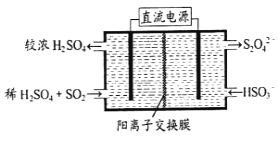
¢Ÿ—Ùº´µƒµÁº´∑¥”¶ ΩŒ™_____________________°£
¢⁄‘⁄ºÓ–‘Ãıº˛œ¬£¨”√“ıº´≈≈≥ˆµƒ»Ð“∫Œ¸ ’NO2£¨ π∆‰◊™ªØŒ™ŒÞ∫¶∆¯Ã£¨Õ¨ ±”–SO32-…˙≥…°£∏√∑¥”¶÷–—ıªØº¡”Ϊπ‘≠º¡µƒŒÔ÷ µƒ¡ø÷Ʊ»Œ™_______________°£
(3)“ª∂®Ãıº˛œ¬ø…”√º◊¥º”ÎCO∑¥”¶…˙≥…¥◊À·œ˚≥˝COŒ€»æ°£≥£Œ¬œ¬£¨Ω´∫¨a molCH3COOHµƒ¥◊À·»Ð“∫”Î∫¨b molBa(OH)2µƒ«‚—ıªØ±µ»Ð“∫ªÏ∫œ£¨≥‰∑÷∑¥”¶∫Û£¨»Ð“∫≥ ÷––‘£¨‘Ú¥◊À·µƒµÁ¿Î≥£ ˝Ka=______________________(”√∫¨a∫Õbµƒ¥˙ ˝ Ω±Ì æ)°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øπÿ”⁄µŒ∂® µ—ȵƒœ¬¡–Àµ∑®’˝»∑µƒ «
A.‘⁄À·ºÓ÷–∫ÕµŒ∂®π˝≥Ã÷–£¨—€æ¶”¶◊¢ ”◊∂–Œ∆øƒ⁄»Ð“∫—’…´µƒ±‰ªØ
B.”√NaOH±Í◊º»Ð“∫µŒ∂®Œ¥÷™≈®∂»µƒ—ŒÀ·£¨µΩ¥Ô÷’µ„ ±∑¢œ÷µŒ∂®πк‚◊Ï≤ø∑÷”––¸µŒ£¨ª· π≤‚∂®Ω·π˚∆´–°
C.”√![]() ±Í◊º»Ð“∫µŒ∂®≤ðÀ· ±£¨
±Í◊º»Ð“∫µŒ∂®≤ðÀ· ±£¨![]() ±Í◊º»Ð“∫ ¢◊∞‘⁄ºÓ ΩµŒ∂®πÐ÷–
±Í◊º»Ð“∫ ¢◊∞‘⁄ºÓ ΩµŒ∂®πÐ÷–
D.À˘”–µƒµŒ∂® µ—È∂º–˺”»Î÷∏ 溡
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘⁄0.1 mol/LµƒNa2CO3»Ð“∫÷–£¨œ¬¡–πÿœµ Ω’˝»∑µƒ «£® £©
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com