
【题目】钴及其化合物可应用与催化剂、电池、颜料与染料等。
(1)CoO是一种油漆添加剂,可通过反应①②制备。
①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1
②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1
则反应2Co(s)+O2(g)+2CO2(g)=2CoO3(s) 的ΔH=_________。
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极的电极反应式为_________,Li+向______移动(填“正极”或“负极“)。
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4。该反应的化学方程式为___________________。
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图-1所示,该循环的总反应方程式为_________________(反应条件无需列出)

(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx。不同温度下,将10mol模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图-2所示.
模拟尾气 | 气体 | 碳烟 | ||
NO | O2 | He | ||
物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |

①380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为__________________。
②实验过程中采用NO模拟NOx,,而不采用NO2的原因是______________________。
【答案】 (a-2b)kJ·mol-1 LiC6-e-═Li++C6 正极 2LiCoO2+H2O2+3H2SO4═LiSO4+2CoSO4+4H2O+O2↑ CO+CH3OH→CH3COOH N2O 真实的尾气中的NOx以NO为主(或NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定)
【解析】 (1) ①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1,②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1,根据盖斯定律,将①-②×2得:2Co(s)+O2(g)+2CO2(g)=2CoO3(s) ,ΔH= (a-2b)kJ·mol-1,故答案为:(a-2b)kJ·mol-1;
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极发生氧化反应,反应的电极反应式为LiC6-e-═Li++C6,原电池中,阳离子向正极移动,Li+向正极移动,故答案为:LiC6-e-═Li++C6;正极;
②将LiCoO2与H2O2、H2SO4反应生成CoSO4,反应的化学方程式为2LiCoO2+H2O2+3H2SO4═LiSO4+2CoSO4+4H2O+O2↑,故答案为:2LiCoO2+H2O2+3H2SO4═LiSO4+2CoSO4+4H2O+O2↑;
.(3)根据图-1所示,该循环的总反应方程式为CO+CH3OH→CH3COOH,故答案为:CO+CH3OH→CH3COOH;
(4)①10mol模拟尾气中含有0.025molNO,0.5mol O2,380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,因此反应的氧气为0.05mol,根据图像反应的NO为(8%+16%)×0.025mol=0.006mol,根据N守恒,生成的N2或N2O的物质的量分别为0.001mol和0.002mol,设N2O的物质的量为x,根据O原子守恒,0.006mol+0.05mol×2=0.0525 mol×2+x,解得x=0.001mol,因此Y为N2O,故答案为:N2O;
②真实的尾气中的NOx以NO为主,而且NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定,因此实验过程中采用NO模拟NOx,,而不采用NO2,故答案为:真实的尾气中的NOx以NO为主。


科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧的含量是衡量水质的一个重要指标,某实验兴趣小组通过如下步骤来测量水中溶解氧的含量:
步骤一:向溶解氧测量瓶中注入20.00 mL水样,再分别加入1 mL 0.1 mol L-1MnSO4溶液和3mL NaOH和KI的混合溶液,充分反应。此时发生反应的化学方程式为: Mn2++2OH-=Mn(OH)2↓ 2Mn(OH)2+ O2 =2MnO(OH)2
步骤二:向上述混合物中加入1.5 mL浓硫酸,充分反应后制沉淀完全溶解,此时溶液呈黄色。
步骤三:将溶液全部转移到容量瓶中,向其中滴加23滴淀粉溶液,溶液呈蓝色。用 0.005 mol L-1的Na2S2O3标准溶液滴定至蓝色恰好消失,共消耗Na2S2O3标准溶液3.60 mL。此时发生反应为:
I2+2Na2S2O3= 2NaI + Na2S4O6
(1)25 ℃时,步骤一中当加入NaOH使溶液的pH = 12时,此时溶液中的c(Mn2+)=_________mol L-1 。 (已知 KspMn(OH)2 =2.06×10-13)
(2)写出步骤二中所发生反应的化学方程式:______________________________。
(3)计算该水样中溶解氧的含量。(单位:mg L-1,请写出计算过程)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
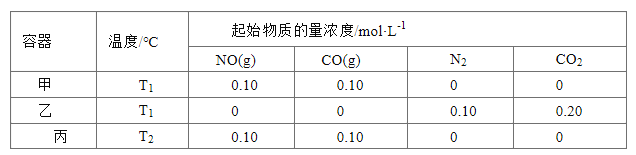
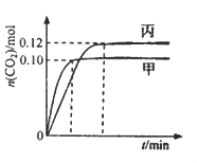
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率小于50%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人体所需的16种微量元素中有一种被称为生命元素的R元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称
A. 硫 B. 碘 C. 硒 D. 硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置进行试验
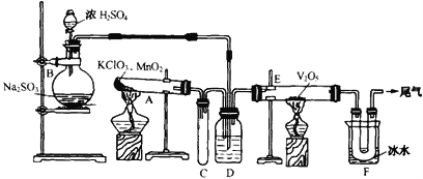
(1)烧瓶B内发生反应的化学方程式是________________。在本实验中,往往选择质量分数75%左右的浓硫酸,试分析其原因________________。
(2)小试管C的作用是________________。
(3)广口瓶D内盛的试剂是____________,装置D的3个作用是:①_________、②_______、③_________。
(4)玻璃管E内发生反应的化学方程式是________________。
(5)装置F中U形管中所收集物质的成分是________________。
(6)若U形管内收集到的物质很少,分析其原因不可能是______________(填序号)。
a、装置气密性不好
b、制得的SO2中混有少量H2S杂质使催化剂中毒;
c、气流速度过快。
(7)从U形管导出的尾气的处理方法是________________,相关反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某一元弱酸(HA)和氢氧化钠溶液混合后溶液呈中性,则此溶液中c(Na+)与c(A-)的关系为( )
A. c(Na+)=c(A-) B. c(Na+)<c(A-) C. c(Na+)>c(A-) D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质是( )
A.胶体粒子带电荷并且在一定条件下能稳定存在
B.胶体粒子不能穿过半透膜,能通过滤纸空隙
C.胶体的分散质粒子直径在1nm~100nm之间
D.胶体粒子能够发生布朗运动而且能产生丁达尔现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com