
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
【答案】B
【解析】
试题分析:A、常温下,结合水的离子积常数计算,溶液中的氢离子浓度为0.001mol/L,溶液的pH=3,错误,不选A;B、酸溶液中水电离出的氢离子浓度等于溶液中的氢氧根离子浓度,所以该溶液中由水电离出的氢离子浓度为c(H+)=1×10-11mol/L,正确,选B;C、温度不变,水的离子积常数不变,所以该溶液中水的离子积常数为1×10-14,错误,不选C;D、pH=11的氢氧化钠溶液中氢氧化钠的浓度为0.001mol/L,氢氧化钠是强碱,HA为弱酸,假设HA为强酸,则氢氧化钠和算的体积之比为100:1,实际上HA为弱酸,要使混合溶液呈中性则氢氧化钠与HA体积之比小于100:1,但仍然存在V1>V2,错误,不选D;故答案为B。


科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是

A. 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量
B. 反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(a-b)KJ/mol
C. 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量
D. 加入适当的催化剂,可以加快正、逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L 的密闭容器中,X、Y、Z物质的物质的量随时间的变化曲线如图。所示根据图中数据,试填写下列空白:

(1)该反应的化学方程式为______;
(2)反应开始至2min,气体Z的平均反应速率为______;
(3)若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是________;
(4)以下说法能列定该反应已达平衡状态的是________
A.X、Y、Z的浓度之比是1:2:3
B.X的消耗速率和Y的生成速率相等
C.Z的浓度保持不变
D.单位时间内生成0.03molZ的同时生成0.02mol的Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学电源的工作原理如图。下列说法不正确的是( )
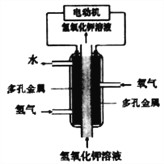
A. 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力
B. 通H2的电极作负极,发生氧化反应
C. 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O
D. 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
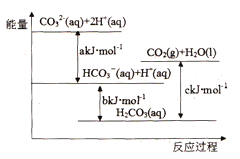
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理燃烧产生的烟道气CO和SO2,方法之一是在一定条件下将其催化转化为CO2和S。
已知:①2CO(g)+O2(g)![]() 2CO2(g) H=-566.0kJ/mol
2CO2(g) H=-566.0kJ/mol
②S(g)+O2(g)![]() SO2(g) H=-296.0kJ/mol
SO2(g) H=-296.0kJ/mol
下列说法中正确的是
A. 转化①有利于碳参与自然界的元素循环
B. 转化②中S和O2属于不同的核素
C. 可用澄清的石灰水鉴别CO2与SO2
D. 转化的热化学方程式是:2CO(g)+ SO2(g) ![]() S(s)+ 2CO2 (g) H =+270kJ/mol
S(s)+ 2CO2 (g) H =+270kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生资源。
(1)已知:2CH4(g)+O2(g) =2CO(g)+4H2(g) △H=akJmol-1
CO(g) +2H2(g)=CH3OH(g) △H=bkJmol-1
写出由CH4和O2制取CH3OH(g)的热化学方程式:____________________________。
(2)反应:CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K的表达式为________________;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________。
CH3OH(g)的平衡常数K的表达式为________________;甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线。从反应开始至达到平衡时,用H2表示的反应速率υ(H2)=________________。
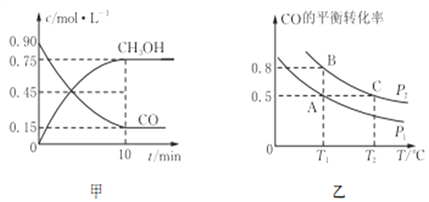
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图乙所示。
①能判断该反应达到化学平衡状态的是_______(填选项字母)。
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较A、B两点压强大小P(A)________P(B)(填“>、<、=”)。
③比较KA、KB、KC的大小:________________。
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若KOH溶液足量,写出燃料电池负极的电极反应式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物可应用与催化剂、电池、颜料与染料等。
(1)CoO是一种油漆添加剂,可通过反应①②制备。
①2Co(s)+O2(g)=2CoO(s) ΔH1=akJ·mol-1
②2CoCO3(s) =CoO(s) + CO2 (g) ΔH2=akJ·mol-1
则反应2Co(s)+O2(g)+2CO2(g)=2CoO3(s) 的ΔH=_________。
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2![]() C6+LiCoO2
C6+LiCoO2
①电池放电时,负极的电极反应式为_________,Li+向______移动(填“正极”或“负极“)。
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4。该反应的化学方程式为___________________。
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图-1所示,该循环的总反应方程式为_________________(反应条件无需列出)

(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx。不同温度下,将10mol模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图-2所示.
模拟尾气 | 气体 | 碳烟 | ||
NO | O2 | He | ||
物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |

①380℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为__________________。
②实验过程中采用NO模拟NOx,,而不采用NO2的原因是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com