
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
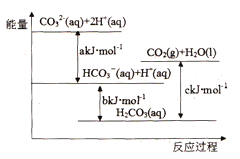
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向________(填“正”或“逆”)反应方向移动;溶液中![]() 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5 mol·L-1;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________。
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=__________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
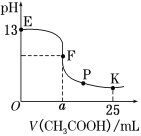
A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO45H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是____________
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的____________
A.NaOH B.NH3H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL-1,则Cu(OH)2开始沉淀时溶液的pH为____________,Fe3+完全沉淀[即c(Fe3+)≤1×10-5 molL-1]时溶液的pH为____________,通过计算确定上述方案_____________ (填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中,不能大量共存的离子组是( )AC
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
A. 950mL,111.2g B. 950mL,117.0g
C. 1000mL,117.0g D. 1000mL,111.2g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com