
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):
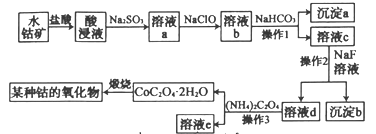
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
【答案】将水钴矿石粉碎 ;充分搅拌;适当增加盐酸浓度;提高酸浸温度等 ![]() 将溶液中Fe2+氧化成Fe3+ Fe(OH)3、Al(OH)3 过滤 使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去 3CoC2O4+2O2
将溶液中Fe2+氧化成Fe3+ Fe(OH)3、Al(OH)3 过滤 使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去 3CoC2O4+2O2![]() Co3O4+6CO2
Co3O4+6CO2
【解析】
水钴矿中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+;加入NaClO将Fe2+氧化为Fe3+,溶液b中阳离子有Co2+、Fe3+、Al3+、Mg2+、Ca2+,加入碳酸氢钠,Fe3+、Al3+与碳酸氢根离子发生相互促进的水解反应分别生成Fe(OH)3、Al(OH)3,故沉淀A的主要成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+,加入NaF,Mg2+、Ca2+转化成MgF2、CaF2沉淀,溶液d中含有Co2+,溶液d中加入草酸铵过滤得到CoC2O4晶体,最后煅烧得到钴的氧化物,据此分析作答。
(1)“酸浸”时为固体与液体的反应,根据外界条件对化学反应速率的影响,在加入盐酸进行“酸浸”时,能够提高“酸浸”速率的方法有:将水钴矿石粉碎,增大接触面积;充分搅拌;适当增加盐酸的浓度;适当提高酸浸的温度等,故答案为:将水钴矿石粉碎;充分搅拌;适当增加盐酸浓度;提高酸浸温度等。
(2)酸浸时水钴矿中的Co2O3、Fe2O3、Al2O3、MgO、CaO溶解转化为CoCl3、FeCl3、AlCl3、MgCl2、CaCl2;加入Na2SO3,钴的存在形式为Co2+,Co3+被还原为Co2+,则SO32-被氧化成SO42-,产生Co2+的反应可表示为:SO32-+Co3+→Co2++SO42-,根据得失电子守恒配平为:SO32-+2Co3+→2Co2++SO42-,根据溶液呈酸性和电荷守恒,生成Co2+的离子方程式为SO32-+2Co3++H2O=2Co2++SO42-+2H+;
(3)加入Na2SO3还会将Fe3+还原为Fe2+,反应的离子方程式为SO32-+2Fe3++H2O=2Fe2++SO42-+2H+;溶液a中含有Co2+、Fe2+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液a中加入NaClO,NaClO具有强氧化性,将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,故答案为:将溶液中Fe2+氧化成Fe3+;
(4)加入NaClO溶液后得到的溶液b中含有Co2+、Fe3+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等;向溶液b中加入NaHCO3调节溶液的pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去,沉淀A的成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液c中加入NaF,Mg2+、Ca2+转化为难溶于水的
(5)根据(4)的分析,溶液c中加入NaF溶液的作用是使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去,故答案为:使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去;
(6)n(CO2)=![]() =0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=
=0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=![]() =0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2
=0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2![]() Co3O4+6CO2。
Co3O4+6CO2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
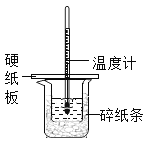
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
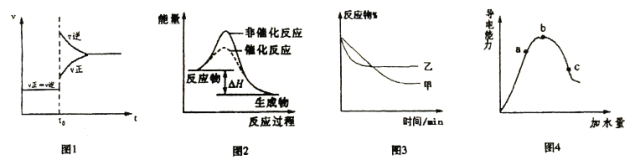
A.图1表示A(g)+B(g)![]() 3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
3C(g)+2D(s) △H<0,达到平衡后升高温度成增大压强时的速率—时间变化图像
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示压强对可逆反应A(g)+B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
D.图4表示冰醋酸加水稀释,导电能力的变化图像,其中b点醋酸电高程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
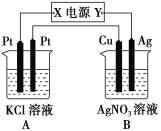
(1)电源电极X的名称为______(填“正极”或“负极”)。
(2)电解池B中阳极的电极反应式是:__________________________________________。
(3)若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16 g时A中溶液的pH=________(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复
到与电解前完全相同的状态,则应加入________(填物质的种类及物质的量)。
(4)当铜、银两电极的质量差为2.16 g时,A中生成的气体最多为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
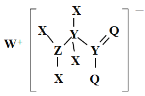
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是

A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物,其合成路线如下:

(1)G中的含氧官能团名称为羟基、____、____。
(2)A→B的反应类型为____。
(3)E的结构简式为____。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:____。
Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.能与FeCl3发生显色反应,核磁共振氢谱图中有4个峰。
(5)已知:![]() (R’表示烃基或氢原子)。请写出以
(R’表示烃基或氢原子)。请写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。_______
的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com