
【题目】根据题目要求,用化学语言回答问题。
I.某有机物的实验式为C2H6O,用质谱仪测定其相对分子质量,经测定得到如图1所示的质谱图;最后用核磁共振仪处理该有机物,得到如图2所示的核磁共振氢谱图。

试回答下列问题:
(1)该有机化合物的相对分子质量为_______________。
(2)请写出该有机化合物的结构简式_______________。
II.化合物X是一种香料,可采用乙烯与甲苯为主要原料,按如图路线合成:

(1)写出由乙烯制取A的化学方程式:___________________________________________
(2)以乙烯为原料制得乙炔第二步反应的条件是________________________________
(3)写出B和D反应生成F的化学方程式:________________________________________
(4)写出C→D的化学方程式:__________________________________________________
【答案】46 CH3OCH3 CH2=CH2+H2O![]() CH3CH2OH 氢氧化钠的乙醇溶液、加热
CH3CH2OH 氢氧化钠的乙醇溶液、加热 ![]()
![]() +NaOH
+NaOH![]()
![]() +NaCl
+NaCl
【解析】
I、由质荷比可知相对分子质量为46,有机物的实验式为C2H6O,则分子式为C2H6O,核磁共振氢谱只有1个吸收峰,故该有机物为甲醚。
II、乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是乙醇,乙醇催化氧化最终生成乙酸,故B是乙酸;甲苯在光照条件下与氯气发生的是取代反应,则C为![]() ,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为
,C在氢氧化钠的水溶液中发生的是取代反应,那么D应为![]() ,由D能被氧化为E,那么应E为
,由D能被氧化为E,那么应E为![]() ,据此推断得出F为:
,据此推断得出F为:![]() ,那么X为
,那么X为![]() 。
。
I、(1)由质谱图可知,最右边的粒子峰为该有机物的相对分子质量,故该有机物相对分子质量为46,故答案为:46;
(2)有机物的相对分子质量为46,有机物的实验式为C2H6O,则分子式为C2H6O,核磁共振氢谱只有1个吸收峰,故该有机物结构简式为:CH3OCH3,故答案为:CH3OCH3。
II、(1)乙烯与水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O![]() CH3CH2OH,故答案为:CH2=CH2+H2O
CH3CH2OH,故答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(2)以乙烯为原料可以制得乙炔,反应过程为:CH2=CH2与Br2加成生成BrCH2CH2Br,BrCH2CH2Br再发生消去反应生成CH≡CH,第二步反应的条件为:氢氧化钠的乙醇溶液、加热;故答案为:氢氧化钠的乙醇溶液、加热;
(3)B为乙酸,D为苯甲醇,两者发生酯化反应生成乙酸苯甲酯,化学反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)C→D的化学方程式:![]() +NaOH
+NaOH![]()
![]() +NaCl;故答案为:
+NaCl;故答案为:![]() +NaOH
+NaOH![]()
![]() +NaCl。
+NaCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关对定量实验误差分析正确的是( )
A. 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响
B. 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高
C. 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响
D. 现需90mL 1.0molL-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
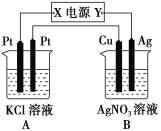
(1)电源电极X的名称为______(填“正极”或“负极”)。
(2)电解池B中阳极的电极反应式是:__________________________________________。
(3)若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16 g时A中溶液的pH=________(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复
到与电解前完全相同的状态,则应加入________(填物质的种类及物质的量)。
(4)当铜、银两电极的质量差为2.16 g时,A中生成的气体最多为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是

A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中有:
① N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
② N2H5++H2O![]() N2H62++OH- K2 ,
N2H62++OH- K2 ,
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是

A. 图中Ⅲ对应的微粒为N2H62+
B. 反应②为N2H5+的水解平衡方程式
C. 若C点为N2H5C1溶液,则存在:c(Cl-)>c(N2H5+ )+2c(N2H62+)
D. 据A点可求:K1=10-6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是

A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
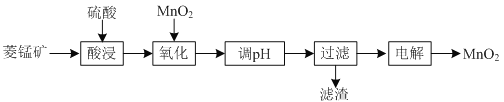
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是__(填序号)
①配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质
(2)若25℃时,0.10mol/L的CH3COOH的电离度为1%,则该溶液的pH=___,由醋酸电离出的c(H+)约为水电离出的c(H+)的___倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com