
19.2g铜与适量的浓HNO3反应,铜全部反应后,共收集到11.2 LNO和NO2混合气体(标准状况),反应消耗HNO3的物质的量是( )
A.0.8 mol B.1.1 mol C.1.2 mol D.2.0 mol
B
【解析】
试题分析:Cu与硝酸反应,开始是浓硝酸,发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;随着反应的进行,硝酸变稀,这时发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。可见在反应中硝酸的作用有两个:一是形成Cu(NO3)2;二是得到电子变为气态氧化物NO、NO2。n(Cu)=m÷M =19.2g÷ 64g/mol=0.3mol.n(气体)=V÷Vm= 11.2 L÷22.4L/mol=0.5mol.所以n(HNO3)=2n(Cu)+ n(气体)=2× 0.3mol+ 0.5mol=1.1mol。故选项为B。
考点:考查守恒法在化学计算中的应用的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
右图所示的装置最适宜于干燥、收集的气体是
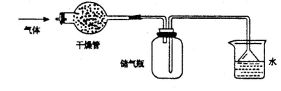
A.NO B.HC1 C.NO2 D.NH3
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(解析版) 题型:填空题
(共8分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。

(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要” 或“不需要”)加 热,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+0.5O2(g)=H2O(g) △H=-241.8 kJ/mol;该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的表示及说法正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+1/2H2SO4 (aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D.已知I2(g)+ H2(g)=2HI(g) △H1, I2(s)+ H2(g)=2HI(g ) △H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(解析版) 题型:选择题
下列关于元素周期表和元素周期律的说法不正确的是( )
A.从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强
B.等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱
C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强
D.氧与硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州八市高一下学期期中考试化学试卷(解析版) 题型:选择题
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
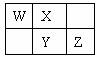
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州八市高一下学期期中考试化学试卷(解析版) 题型:选择题
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是:( )
A.被氧化的元素和被还原的元素的质量之比5:1
B.Cl2既是氧化产物,又是还原产物
C.盐酸既体现酸性,又体现酸性还原性
D.转移5mol电子时,产生67.2L的Cl2
查看答案和解析>>
科目:高中化学 来源:2016届湖北省孝感市七校联考高一下学期期中考试化学试卷(解析版) 题型:填空题
I.用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)
(1)最高价氧化物的水化物碱性最强的是 ;其电子式为:
(2)最高价氧化物的水化物呈两性的是 ;
(3)能形成气态氢化物且最稳定的是 ,其电子式为 .
II.化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
下列说法错误的是 。
A.将Cl2通入紫色石蕊试液,溶液先变红后褪色
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体
D.常温下,可以用铁质容器储运浓硝酸
E.实验室可以用加热氯化铵的方法制取少量氨气
F.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市十校联合体高一下学期期中联考化学试卷(解析版) 题型:选择题
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是

A.产生气体的体积:(1)> (2)
B.电极上析出物质的质量:(1)> (2)
C.溶液pH的变化:(1)增大,(2)减小
D.电极反应式:(1)中阳极:4OH--4e-===2H2O+O2↑,(2)中负极:2H++2e-===H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com