
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
分析 (1)I2在四氯化碳中溶解度大于水中,溶于四氯化碳呈紫红色,Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式;
(2)①溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
②根据KIO3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O中反应方程式计算;
③根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
解答 解:(1)I2在四氯化碳中溶解度大于水中,溶于四氯化碳呈紫红色,确认有I2生成的现象是CCl4层呈紫色,Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式,Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,
故答案为:CCl4层呈紫色,I2+SO32-+H2O=2I-+SO42-+2H+;
(2)①碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断c中反应恰好完全所依据的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,
故答案为:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中生成的碘在c中反应I2+2S2O32-═2I-+S4O62-,所以
I2 ~~~~~~2S2O32-,
1mol 2mol
1.0×10-5mol 2.0×10-3mol•L-1×0.0025L×$\frac{100ml}{25ml}$=2.0×10-5mol,
答:b中反应所产生的I2的物质的量为1.0×10-5;
③根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~~~~~KIO3~~~~~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-5mol
所以m=$\frac{127}{3}$×10-5g,
所以设每千克食盐中含碘$\frac{1000g}{wg}$×$\frac{127}{3}$×10-5g=$\frac{0.423}{w}$g=$\frac{423}{w}$mg,
即为$\frac{423}{w}$mg/kg,
答:根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~~~~~KIO3~~~~~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-5mol
所以m=$\frac{127}{3}$×10-5g,
所以设每千克食盐中含碘$\frac{1000g}{wg}$×$\frac{127}{3}$×10-5g=$\frac{0.423}{w}$g=$\frac{423}{w}$mg,
即为$\frac{423}{w}$mg/kg,测得精制盐的碘(I)含量为$\frac{423}{w}$mg/kg.
点评 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,题目难度中等.


科目:高中化学 来源: 题型:选择题
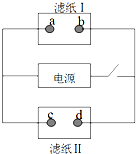 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯能使溴水褪色,是因为苯与溴发生了化学反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
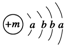 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
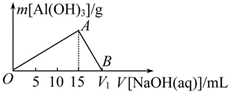 向20mL某浓度的AlCl3溶液中滴加2mol•L-1的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol•L-1的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com