
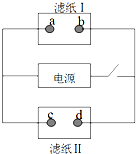
 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
分析 有外接电源的装置是电解池,接通电源一段时间后,发现a点附近变红,说明a为阴极,阴极上水电解生成氢气和氢氧根离子,则b是阳极,电源右端为正极,左端为负极,d为阳极,c是阴极,据此分析.
解答 解:有外接电源的装置是电解池,接通电源一段时间后,发现a点附近变红,说明a为阴极,阴极上水电解生成氢气和氢氧根离子,则b是阳极,电源右端为正极,左端为负极,d为阳极,c是阴极,
A.由分析可知,a为阴极,与电源的正极相连,故A错误;
B.由分析可知,b是阳极,阳极上发生氧化反应,故B错误;
C.c是阴极,阴极上氢离子得电子生成氢气,所以c点附近氢离子浓度减小,则c点附近pH增大,故C错误;
D.d为阳极,高锰酸根离子向阳极移动,所以阳极附近的颜色加深,即d点附近颜色加深,故D正确.
故选D.
点评 本题考查了电解池原理,明确电解氯化钠溶液时溶液中的离子放电顺序是解本题的关键,题目难度不大,注意把握阴阳极和正负极的判断.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | Fe2+、S2O32-都是还原剂 | |
| C. | 硫元素被氧化,铁元素被还原 | |
| D. | 每生成1 mol Fe2O4,则转移电子数为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
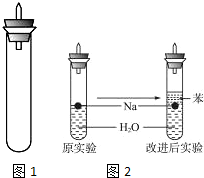 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com