
【题目】(1)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为____________。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为____________mol。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________mL。
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为_______________________________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______________。
【答案】1:7 1.5 60 2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O Co3O4.
【解析】
(1)根据电子转移守恒以及原子守恒进行计算;
(2)根据电子转移守恒进行计算;
(3)根据电子转移守恒以及原子守恒进行计算;
(4)Co(OH)3溶解还原反应为Co(OH)3、H+、SO32-的氧化还原反应;根据质量守恒定律计算氧化物的化学式。
(1)设参加反应的FeS为1mol,则溶液中Fe2(SO4)3为1/3 mol,Fe(NO3)3为1/3 mol,反应中Fe元素、S元素化合价升高,N元素化合价降低,设NO2、N2O4、NO的物质的量均为amol,根据电子转移守恒有:1×(3-2)+1×[6-(-2)]=a×(5-4)+a×(5-4)×2+a×(5-2),解得:a=1.5,则NO2、N2O4、NO的物质的量分别为1.5mol、1.5mol、1.5mol,则起氧化剂作用的HNO3为:1.5mol+1.5mol×2+1.5mol=6mol,起酸的作用的硝酸为1/3 mol×3=1mol,参加反应的硝酸为:6mol+1mol=7mol,所以实际参加反应的FeS与HNO3的物质的量之比=1mol:7mol=1:7;
(2)反应中铜元素化合价从+2价降低到+1价,得到1个电子,P元素化合价从0价升高到+5价,失去5个电子,则根据电子得失守恒可知7.5 mol CuSO4可氧化P的物质的量为7.5mol÷5=1.5mol;
(3)NO2、N2O4、NO的混合气体与1.68L O2(标准状况)混合后通入水中,完全生成HNO3,则整个过程中HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒:n(Cu)×2=n(O2)×4,即n(Cu)×2=1.68/22.4 mol×4,解得:n(Cu)=0.15mol,所以溶液中铜离子为0.15mol,根据Cu2+~2OH-可知NaOH为0.15mol×2=0.3 mol,则NaOH溶液的体积0.3mol÷5mol/L=0.06L=60mL;
(4)Co(OH)3溶解还原反应为Co(OH)3、H+、SO32-的氧化还原反应,其离子反应为2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=1.344L÷22.4L/mol=0.06mol,由化学式可知n(Co)=0.06mol×1/2=0.03mol,则氧化物中n(O)=(2.41g-0.03mol×59g/mol)÷16g/mol=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分子式为 C8H8 的两种同分异构体 X 和 Y。X 是一种芳香烃,分子中只有一个环;Y 俗称立方烷,其核磁共振氢谱显示只有一个吸收峰。下列有关说法错误的是( )
A. X、Y 均能燃烧,都有大量浓烟产生
B. X 既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应
C. ![]() 与 X 互为同系物
与 X 互为同系物
D. Y 的二氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1mol·L-1的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH![]() ):③>①;水电离出的c(H+):①>②
):③>①;水电离出的c(H+):①>②
B. 将pH值相同②和③溶液加水稀释相同的倍数PH变化大的是③
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH![]() )>c(Cl-)> c(NH3·H2O) >c(OH-)>c(H+)
)>c(Cl-)> c(NH3·H2O) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别
A. 1000mL,117gB. 950mL,111.2 g
C. 任意规格,117gD. 500mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+O2(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是
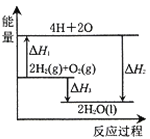
A. H1<0 B. H2为该反应的反应热
C. H1=H3-H2 D. H3为氢气的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素.它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法错误的是
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. Y和Z元素的原子半径大小顺序为Y>Z
C. Z、W元素的最简单氢化物的沸点和稳定性均为H2Z>H2W
D. X与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关它的性质的叙述中,正确的是
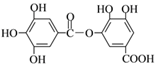
A. 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4 mol Br2
B. 它能发生水解反应,水解后能生成两种产物
C. 在Ni催化下,1 mol该物质可以和7 mol H2发生加成反应
D. 在一定条件下,1 mol该物质最多能与6 mol NaOH完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com