
【题目】某有机物的结构简式如图所示,下列有关它的性质的叙述中,正确的是
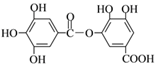
A. 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4 mol Br2
B. 它能发生水解反应,水解后能生成两种产物
C. 在Ni催化下,1 mol该物质可以和7 mol H2发生加成反应
D. 在一定条件下,1 mol该物质最多能与6 mol NaOH完全反应
科目:高中化学 来源: 题型:
【题目】(1)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为____________。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为____________mol。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________mL。
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为_______________________________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一支盛有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2,问:(如剩余气体,写出该气体的化学式,并计算气体体积,如无气体剩余写“无”)
(1)若a=b,则充分反应后试管内剩余气体为_________;气体体积为__________mL。
(2)若a<b,则充分反应后试管内剩余气体为_________;气体体积为__________mL。
(3)若a>b,则充分反应后试管内剩余气体为_________;气体体积为__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),X中一定含有碳元素。

(1)若A为金属单质,B的焰色反应为黄色,请写出A与水反应的离子方程式_____,B与D反应的离子方程式_______________________________。
(2)若A为非金属单质,A与水反应时,H2O既不是氧化剂也不是还原剂,则E的结构式为__________,写出B与D反应的离子方程式_________________________。
(3)若A为化合物,E为离子化合物,请写出E的电子式__________________,写出B与D反应的化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验中的说法正确的是
A. 将碘水倒入分液漏斗中,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B. 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C. 某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO![]()
D. 加浓溴水然后过滤可以除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中加入铝粉有氢气产生,该溶液中肯定可以大量存在的离子组是( )
A. Na+、NO3-、Cl-、Cu2+ B. Na+、K+、Ba2+、HCO3-
C. Mg2 +、K+、SO32-、Cl- D. Na+、K+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com