
【题目】由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
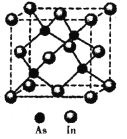
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要化工原料CuSO4的制备途径及性质如图所示。下列说法错误的是
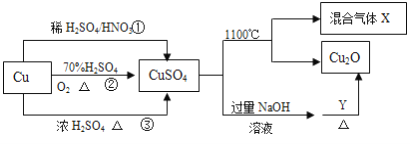
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. Y物质具有还原性,可以是葡萄糖
D. 1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学物质在实际生产、生活和科技等方面的应用正确的是( )
A. 我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B. 生产普通玻璃的主要原料有石灰石、石英和纯碱
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 玻璃上的漂亮花纹都依靠浓硫酸的腐蚀作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A. 同周期IA族和IVA族元素的原子序数之差可能是13
B. 周期表中每个族均占据一个竖列
C. 周期表中非金属元素均位于过渡元素右侧
D. 同主族相邻元素原子序数之差不可能是2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爷爷邀请同学们共进午餐,营养搭配均衡的午餐是( )
A. 米饭、馒头、菜心和白菜
B. 馒头、红烧肉、清蒸鲈鱼和咸菜
C. 米饭、蒜蓉菜心、蒸蛋、清蒸鲈鱼和鲜橙汁
D. 煎饼、油炸鸡腿、油炸花生米、咸菜和红烧肉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com