
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻。已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸。
(1)D元素基态原子的外围电子排布式为____________________。
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为________________(用相应的元素符号作答)。
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答)。
(4)C元素的原子可形成多种离子,试推测下列微粒的立体构型(C为字母,不是碳元素):
微粒 | CO32- | CO42- |
立体构型名称 | _______________ | _______________ |
(5)元素B的一种氢化物B2H4具有重要的用途。有关B2H4的说法正确的是_______。
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E(OH)2为两性氢氧化物,在浓的强碱溶液中可形成E(OH)42-,写出E(OH)2酸式电离的电离方程式___________________。
(7)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为___________,δ、γ、α三种晶胞的边长之比为_____________。

【答案】 4s24p3 P>S>Si NH3>AsH3>PH3 三角锥形 正四面体形 AB Co(OH)2+2H2O![]() Co(OH)42-+2H+ 4:6:3 2
Co(OH)42-+2H+ 4:6:3 2![]()
【解析】元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为磷元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为氮元素,D为砷元素,C的最高价氧化物对应的水化物是强酸,C为硫元素,A为硅元素。
(1)D是砷元素,原子序数为33,其基态原子的外围电子排布式为4s24p3;(2)A、C、X分别为Si、S、P,根据元素周期律,同周期元素从左向右,第一电离逐渐增大,但第ⅡA族和第ⅤA族由于最外层处于全满和半满状态,第一电离能高于相邻族的元素,所以Si、S、P的第一电离能大小顺序为P>S>Si;(3)B、X、D氢化物分别为NH3、PH3、AsH3,因为氨分子之间有氢键的存在,所以氨的沸点较大,AsH3的相对分子质量大于PH3,所以沸点也高于PH3,所以它们的沸点由高到低的顺序为NH3>AsH3>PH3;(4)SO32-的中心原子硫原子的价层电子对数为4,含有一对孤对电子,空间构型为三角锥形;SO42-的中心原子硫原子的价层电子对数为4,没有孤对电子,空间构型为正四面体形;(5)B2H4为N2H4,A.N2H4分子间与NH3相似,可形成氢键,A正确;B.N2H4分子中N原子的价层电子对数为(5+1+1+1)/2=4,所以氮原子是sp3杂化,B正确;C.N2H4分子中N原子之间是单键,所以没有π键,C错误;D.N2H4是分子晶体,所以晶体变为液态时破坏的是分子间作用力和氢键,D错误;答案选AB;(6)E元素和D元素在同一周期,属于VIII族,价层有三个单电子,E是Co,Co(OH)2为两性氢氧化物,在浓的强碱溶液中可形成Co(OH)42-,因此Co(OH)2酸式电离的电离方程式为Co(OH)2+2H2O![]() Co (OH)42-+2H+。(7)δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12。α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6:3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为
Co (OH)42-+2H+。(7)δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12。α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6:3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为![]() 、γ晶胞的边长为
、γ晶胞的边长为![]() 、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为2
、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为2![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】—种微生物燃枓电池如图所示,下列关于该电池说法正确的是:

A. a电极为正极
B. H+由右室通过质子交换膜进入左室
C. a电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作,预测的实验现象和实验结论或解释正确的是
实验操作 | 预测的实验现象 | 实验结论或解释 | |
A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+=H2O+CO2↑ |
B | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容下,有反应2A(g)+2B(g)![]() C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1。以下叙述正确的是( )
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1。以下叙述正确的是( )
A. 达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ的反应速率
B. 达到平衡时,途径Ⅰ所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C. 两途径最终达到平衡时,体系内各组分的百分含量相同
D. 两途径最终达到平衡时,体系内各组分的百分含量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
![]()
判断BaCl2溶液已经过量的方法___________________________________________
第4步中加入Na2CO3溶液的目的是将溶液中的_____(填离子符号)转化为______(填化学式)沉淀而除去。
第6步中加入适量盐酸时发生反应的化学方程式_________________________________________
蒸发结晶时会用到下列仪器中的__________________(填仪器名称)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是

A. 200℃时,反应从开始到平衡的平均速率v(A)=0.08molL-1min-1
B. 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆)
C. 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)![]() C(g) ΔH= +5m kJ/mol
C(g) ΔH= +5m kJ/mol
D. 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
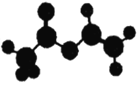
A. 该化合物的名称为乙酸乙酯
B. 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种
C. 该化合物既能发生水解反应.又能发生缩聚反应
D. 该化合物与Br2的四氯化碳溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制500 mL 0.5 mol/L NaOH溶液。
(1)该同学在实验过程中,用到的玻璃仪器有:量筒、玻璃棒、胶头滴管、烧杯___________。
(2)其操作步骤如乙图所示,则甲图操作应在乙图中的 ____ (填选项字母)之间。
A.①与② B.②与③ C.④与⑤ D.⑤与⑥


(3)该同学应称取NaOH固体 ___ g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_____(填小写字母),
附表:砝码规格

a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
并在下图中选出能正确表示游码位置的选项 ____ (填大写字母)。



该同学实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是 ____ (填序号)。
A.称量NaOH固体时,采用了“左码右物” B.容量瓶中原来存有少量水
C.溶解固体的烧杯移液后未洗涤 D.用胶头滴管加水定容时仰视刻度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com