
【题目】化学就在我们身边,它与我们的日常生活密切相关。按要求回答以下问题:
(1)明矾是__________________,漂白粉的有效成分是________(均填化学式)。
(2)用少量氯气消毒的自来水养金鱼时,通常需要先将自来水晒一晒,其原因是________________________________________(用化学方程式表示)。
(3)绿柱石(绿宝石)矿藏其主要化学成分为BenAl2Si6O18,可用氧化物形式表示为nBeO·Al2O3·6SiO2,其n值为_______。
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是___________________。
(5)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式:_________________。
【答案】KAl(SO4)2·12H2O Ca(ClO)2 2HClO![]() 2HCl+O2↑ 3 防止硫酸亚铁被氧化 SiO2+ 2C
2HCl+O2↑ 3 防止硫酸亚铁被氧化 SiO2+ 2C![]() Si+2CO↑
Si+2CO↑
【解析】
(1)明矾可用作净水剂,其化学式是KAl(SO4)2·12H2O,漂白粉的有效成分是Ca(ClO)2;
(2) 氯气消毒的自来水中 存在氯气和水反应生成的盐酸和次氯酸,次氯酸见光分解2HClO ![]() 2HCl+O2↑,分解后HClO就不会再对金鱼有损伤了;
2HCl+O2↑,分解后HClO就不会再对金鱼有损伤了;
(3)nBeOAl2O36SiO2,根据O原子守恒得,n+3+6×2=18,所以n=3;
(4)FeSO4易被氧化而变质,糖衣可起到保护FeSO4不被空气中的氧气氧化,防止Fe2+被氧化生成Fe3+;
(5)工业上用焦炭在高温下还原二氧化硅来获得粗硅,方程式为SiO2+2C ![]() Si+2CO↑。
Si+2CO↑。


科目:高中化学 来源: 题型:
【题目】(化学-物质结构与性质)氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态15N原子的p能级上存在_____个自旋方向相同的电子;CN—中σ键与π键数目之比为_____。
(2)碱性肥料氰氨化钙(CaCN2)的组成元素中第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是____________________________________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为_______________。
(4)阳离子[(CH3)3NH]+和阴离子A按个数比4:1组成化合物,阴离子A的结构如下图所示,则s原子的杂化轨道类型是__________,阴离子A的化学式为_______________。
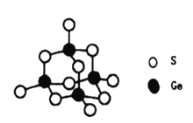
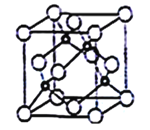
(5)立方氮化硼晶胞如下图所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为___;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出方程式
(1)写出铝与氢氧化钠溶液反应的离子方程式_________________________________。
(2)过氧化钠与水反应的离子方程式__________________________________。
(3)工业上制取漂白粉的化学方程式为___________________________________。
(4)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边振荡,未得到白色沉淀的原因是发生了_______反应(写出反应的化学方程式)。
(5)氨的催化氧化反应的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)
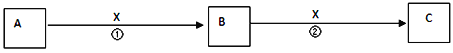
(1)若X是氧气,则A不可能是________________。
A.CB.SiC.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为____________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则B的化学式为________。
(4)若X为盐酸,A、B、C均含碳元素,A的焰色反应呈黄色,则反应①的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学研究中常用的方法.下列分类方法中,正确的是
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.NH4Cl组成中不含金属离子,不属于盐
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.依据组成元素的种类,将纯净物分为单质和化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 标准状况下,2.24 L HF含有的原子数目为0.2NA
B. 电解精练铜时,阳极质量减少6.4 g时,转移电子数一定为0.2NA
C. 常温常压下,将足量的铁粉投入含1 mol HNO3的浓硝酸中,转移的电子总数为NA
D. 将硫酸钠固体投入水中,如果n(SO![]() )=0.5 mol,则Na+数目为NA
)=0.5 mol,则Na+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式,书写正确的是
A. Al2(SO4)3=2Al3++ 3SO42- B. AlCl3= Al3++Cl-
C. Mg(NO3)2= Mg+2+2NO3- D. KMnO4=K++Mn7++4O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①碘水;②银氨溶液;③NaOH溶液;④稀硫酸;⑤浓硫酸。在进行淀粉的水解实验(包括检验水解产物及水解是否完全)时,除淀粉外,还需使用上述试剂或其中一部分,判断使用的试剂及其先后顺序为( )
A.④①③② B.①④②③
C.⑤①③② D.①⑤②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com