
【题目】已知在温度T1和T2时水的电离平衡曲线如图所示,下列说法错误的是( )
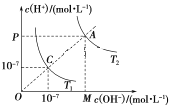
A.水的离子积常数关系为:C<A
B.升高温度可实现由C点到A点
C.T2时,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,所得溶液的pH=7
D.图中矩形OMAP的面积表示T2时水的离子积的值
【答案】C
【解析】
A.C点条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,因为A点氢离子和氢氧根离子浓度都比C点大,所以水的离子积常数Kw,C<A,故A正确;
B.升高温度,促进水的电离,所以溶液中的氢离子和氢氧根浓度都增大,所以可实现由C点到A点,故B正确;
C.T2时Kw=c(H+)×c(OH-)>10-14,pH=10的氢氧化钠中含氢氧根离子的浓度为:c(OH-)>1×10-4mol/L;pH=4的H2SO4溶液含氢离子的浓度为:c(H+)=1×10-4mol/L,二者等体积混合,所以n(OH-)>n(H+),溶液呈碱性,pH≠7,故C错误;
D.图中矩形OMAP的面积即为A点c(H+)×c(OH-),所以矩形OMAP的面积表示T2时水的离子积的值,故D正确;
故选C。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA
D. 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空格。
(1)写出镍(Ni)的基态原子核外电子排布式__________________________。
(2)画出氮(N)原子价电子的电子排布图___________________________。
(3)CH≡CCH(CH3)2系统命名法命名为______________________。
(4)2,3-二甲基-1-丁烯的结构简式为___________________________。
(5)支链只有一个乙基且式量最小的烷烃的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是

A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
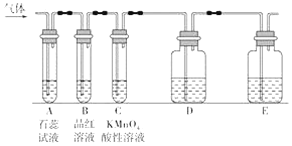
(1)从物质分类的角度,SO2属于____(填“酸性”或“碱性”)氧化物。
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是________________。
②当向该装置通入SO2时,A中实验现象为_________,用化学用语解释其原因___________。
(2)从元素化合价的角度分析,SO2具有___性。
①当向该装置通入SO2一段时间后,可观察C中实验现象为___,说明SO2具有_____性。
②如验证SO2还具有另一方面的性质,可选择的药品是___,实验现象__________。
A.过氧化氢 B.浓硫酸C.氯水 D.硫化钠溶液
(3)B中的品红溶液现象是___________,证明SO2具有_________性。
(4)多余的SO2一般用氢氧化钠溶液吸收,反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
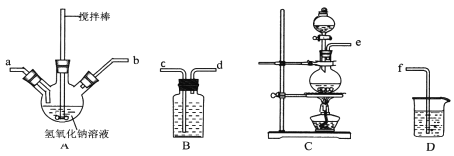
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
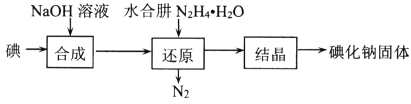
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是
A.Al3+、![]() 、K+、
、K+、![]() B.Ca2+、H+、
B.Ca2+、H+、![]() 、
、![]()
C.OH-、![]() 、
、![]() 、Al3+D.Fe3+、Mg2+、
、Al3+D.Fe3+、Mg2+、![]() 、Clˉ
、Clˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com