
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA
D. 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
科目:高中化学 来源: 题型:
【题目】化学在生产、生活中有广泛应用,下列对应关系不正确的是
化学性质 | 实际应用 | |
A | SO2具有漂白性 | 用SO2漂白纸浆 |
B | Fe3+水解生成胶体 | 硫酸铁可用作净水剂 |
C | 维生素C易被氧气氧化 | 维生素C用作食品抗氧化剂 |
D | 硫酸是一种强酸 | 硫酸可用于除去锅炉中的水垢 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )

A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

(1)放电时,正极的电极反应式为______________________________________________。
(2)若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为________ g。
(3)选用高氯酸钠-四甘醇二甲醚作电解液的优点是___________________________________(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。

请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________。
(4)装置D的作用是___________________________。
(5)读取N2的体积时,应注意
①______________________
②______________________
③______________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是工业上以含金、银、铂、铜的金属废料提取金、银、铂的工艺流程。

已知:溶液I中铂和金形成化合物为H[AuC14]和H2[PtCl6]。浓盐酸物质浓度:12mol/L,密度1.179g/cm3;浓硝酸质量分数约为65%,密度约为1.4g/cm3
(1)写出NH4C1的电子式______________。
(2)操作I中金属废料应该连接电源的____极,若另一极采用纯铜,该过程的工业名称为________________。
(3)依据信息和所学知识,王水配制的具体操作为_________________。
(4)通入SO2的作用是__________,SO2不能通入过量的原因是_____________。
(5)阳极泥与王水反应,硝酸被还原为NO,请写出其中一个反应的化学方程式______________。
(6)由银制备银-氯化银参比电极的工作原理如图所示。一段时间后与A连接的电极就会被氯化银覆盖,当乙池中产生0.2g气体时,甲池溶液质量变化为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g·cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇。实验室中由甲苯(式量:92,密度为0.8669 g·cm-3)制备苯甲酸的实验如下:
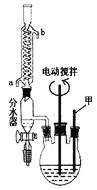
第一步:将18.4g甲苯和硫酸酸化的KMnO4溶液置于如图的三颈瓶中,加热保持反应物溶液温度在90℃左右至反应结束。
第二步:将反应后混合液过滤,滤液用浓盐酸酸化,抽滤得粗产品。
第三步:粗产品用水洗涤2到3次,干燥称量得固体23.4g。
请回答下列问题:
(1)仪器甲的名称为_________________。
(2)第一步发生反应的化学方程式为____________________________。
(3)第二步中抽滤的优点是____________________________________。
(4)第三步证明洗涤干净的方法是_________________________________;
干燥的最佳方法是________ (填代号)
a.空气中自然风干b.沸水浴上干燥c.直接加热干燥
(5)由以上数据知苯甲酸的产率为_____________。
(6)某学生为测定苯甲酸的电离平衡常数设计实验如下:常温下,将a mol苯甲酸和b mol KOH混合加水形成2L溶液,测得溶液的pH=7,请用含a、b的代数式表示出苯甲酸的Ka=____________,该溶液中的离子浓度大小关系为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入氯气,关闭弹簧夹B时,C处红色布条无明显的变化,打开弹簧夹B时,C处红色布条逐渐褪色。由此作出的判断正确的是( )

A. D中不可能是浓硫酸
B. D中可以是水
C. 通入的氯气中含有水蒸气
D. D中可以是饱和食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com