
【题目】将铝投入到下列物质中,没有氢气生成的是( )
A.稀硫酸B.氢氧化钠溶液C.浓硫酸D.盐酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA
D. 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 和泥沙,可将粗盐溶于水,然后进行下列五项操作:
和泥沙,可将粗盐溶于水,然后进行下列五项操作:
①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
通过教材中“粗盐的提纯”及你做过的该实验回答下列问题:
(1)以上五步操作中,最后进行的是________。
(2)实验室进行NaCl溶液的蒸发时,一般有以下操作过程:
①固定铁圈位置 ②放置酒精灯 ③放上蒸发皿(蒸发皿中盛有NaCl溶液) ④加热搅拌
⑤停止加热
正确的操作顺序为________。
(3)在粗盐经过一系列操作后的溶液中滴加过量饱和Na2CO3溶液。请问这步操作的目的是______________________。判断Na2CO3溶液已经过量的方法是__________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:______________________________________________________________。
过滤时:______________________________________________________________。
蒸发时:______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO![]() -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
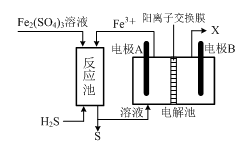
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:


(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
(3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于取代反应的是( )
A. 苯与溴水混合,水层褪色 B. 甲苯制三硝基甲苯
C. 乙醇在浓硫酸作用下制取乙烯 D. 苯和氯气在一定条件下生成六氯环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,不涉及化学变化的是 ( )。
A. 甘油加水作护肤剂
B. 用明矾净化水
C. 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
D. 烧菜用过的铁锅,经放置常出现红棕色斑迹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 同周期元素中,ⅠA族元素的原子半径最小
B. ⅥA 族元素的原子,其半径越大,越容易得到电子
C. 室温时,零族元素的单质都是气体
D. 所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com