
【题目】实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。

请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________。
(4)装置D的作用是___________________________。
(5)读取N2的体积时,应注意
①______________________
②______________________
③______________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________。
【答案】 避免残留在装置中的空气对实验结果产生影响。 A、D D 4CxH yNzOp + (4x + y -2p)O2 → 4x CO2 + 2yH2O + 2z N2 除去未反应的O2 ,防止对读取N2的体积产生影响 冷却至室温 调节量筒高度,使E、F中液面高度一致 读数时,视线与凹液面最低点相平 B、C两装置的增重量
【解析】该实验原理为:mg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。通过测定CO2、H2O和N2的质量,确定分子中三种元素原子个数比,由此确定最简式。
(1)装置的空气中含有N2,影响生成氮气的体积测定,需将装置中的N2排净,因此通入一段时间的氧气的目的是避免残留在装置中的空气对实验结果产生影响;(2)为保证氨基酸完全燃烧需通过量的氧气,利用铜网和氧气在加热条件下反应除去未反应完氧气,以防止影响N2的体积的测定,因此需要加热的仪器有A、D。操作时应先点燃D处的酒精灯。(3)A装置中发生反应的化学方程式是 4CxH yNzOp +(4x + y-2p)O2 ![]() 4x CO2 + 2yH2O + 2z N2。(4)根据以上分析可知装置D的作用是除去未反应的O2 ,防止对读取N2的体积产生影响;(5)利用排水法测定氮气的体积,确定mg该种氨基酸中含氮元素质量.读氮气体积时应注意冷却至室温,调节量筒高度,使E、F中液面高度一致,读数时,视线与凹液面最低点相平。(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,根据以上分析可知还需要的有关数据是 B、C两装置的增重量。
4x CO2 + 2yH2O + 2z N2。(4)根据以上分析可知装置D的作用是除去未反应的O2 ,防止对读取N2的体积产生影响;(5)利用排水法测定氮气的体积,确定mg该种氨基酸中含氮元素质量.读氮气体积时应注意冷却至室温,调节量筒高度,使E、F中液面高度一致,读数时,视线与凹液面最低点相平。(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,根据以上分析可知还需要的有关数据是 B、C两装置的增重量。


科目:高中化学 来源: 题型:
【题目】有下列几种有机化合物的结构简式:(选填序号,下同)
①CH3CH═CH﹣CH2CH3 ② ③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥
③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥![]()
⑦CH3CH2CH2OCH3 ⑧![]() ⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
(1)互为同分异构体的是______________ (2)互为同系物的是___________
(3)官能团位置不同的同分异构体是_______ (4)官能团类型不同的同分异构体是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互反应,已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是
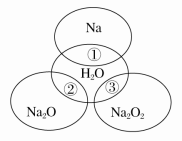
A.反应③最多能产生0.05 mol O2
B.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑
C.Na2O2中阴阳离子数目之比为1∶1
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA
D. 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁盐或其氧化物在生产生活和科学实验中应用广泛。
(1)一定条件下Fe2O3与甲烷反应制取纳米级铁,同时生成CO和H2。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.0kJ/mol
①反应Fe2O3(s)+3 CH4(g)![]() 2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
2Fe(s)+3CO(g) +6H2(g)的△H______0(填“>”、“<”或“=”)
②若该反应在5L的密闭容器中进行,1min后达到平衡,测得体系中固体质量减少0.96g。则该段时间内CO的平均反应速率为__________。
③若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是______(选填序号)
a.c(CH4)=c(CO)
b.固体的总质量不变
c.v(CO)与v(H2)的比值不变
d.混合气体的平均相对分子质量不变
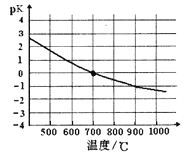
④该反应的化学平衡常数的负对数pK随反应温度T的变化曲线如下图。试用平衡移动原理解释该曲线的变化规律:______________________。若700℃时测得c平衡(H2)=1.0mol·L-1,则CH4的转化率为_________。
(2)菱铁矿的主要成分是:FeCO3,实验室中可以通过FeSO4与NaHCO3溶液混合制得FeCO3,有关反应的离子方程式为:____________________。已知Ksp[FeCO3]=3.2×10-11,H2CO3的Ka1=4.30×10-7,Ka2=5.61×10-11。试通过以上数据简要计算说明该反应能进行的原因_____________________。
(3)Na2FeO4是一种高效净水剂,工业上以Fe为阳极,NaOH为电解质溶液进行电解制备, 写出阳极电极反应式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酸碱中和滴定实验操作或说法正确的是
A. 洗净的锥形瓶须烘干后再滴入待测液
B. 用待测溶液润洗锥形瓶可以减小误差
C. 若滴定终点时,俯视刻度线记录数据,会导致测定结果偏高
D. 满定管装待测溶液前,须先水洗,后再用该溶液润洗以减小误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO![]() -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
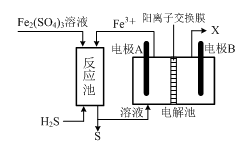
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com